ゼブラフィッシュにおける脊椎動物のセグメンテーションを研究する3D尾翼植物培養
Summary
ここでは、ゼブラフィッシュ後部体軸の3次元組織培養に関するプロトコルを提示し、脊椎動物のセグメンテーションの実生研究を可能にする。この外植モデルは、軸伸長、モルフォゲン源の変化、および細胞内分解能組織レベルのライブイメージングを制御します。
Abstract
脊椎動物の胚は、脊椎、筋肉、および皮膚の前駆体である反復性スマイトとして主体軸をパターン化する。節内皮(PSM)から徐々に胚の尾端が後方に伸びる。スミテは、周期性とサイズの尺度を持つ形をする。ゼブラフィッシュは、遺伝的に難解であり、生きたイメージングを可能にする透明な胚を有するため、人気のあるモデル生物です。それにもかかわらず、ソミト生成の間に、魚の胚は大きな丸い黄身に包まれる。この幾何学は、特に近い目的の作業距離を必要とするより高い解像度で、ゼブラフィッシュ胚におけるPSM組織の生画像を制限する。ここでは、ゼブラフィッシュの尾葉の生画像化のための平坦化された3次元組織培養法を提示する。尾部外植は、軸伸びの比例減速とロストロコーダルスマイト長さの短縮を表示することによって、無傷の胚を模倣する。さらに、外植培養を通じて軸伸び速度を失速させることができる。これにより、信号勾配の化学入力を軸伸長の機械化入力から解き放つ。今後の研究では、この方法をマイクロ流体セットアップと組み合わせて、薬物侵入の懸念なしに、時間制御された医薬品摂動または脊椎動物セグメンテーションのスクリーニングを可能にすることができる。
Introduction
生物のメタメリックセグメンテーションは、自然界で広く使用されています。反復構造は、椎骨、筋肉、神経、血管、手足、またはボディプラン1の葉のような側面器官の機能性に不可欠である。このような軸対称性の生理学的および幾何学的制約の結果として、アネリド、節足動物、およびそれらの胚組織(例えば、外胚、メソダーム)の後方のセグメンテーションのようなビラテリアの大部分のフィラテリアの系統。
脊椎動物胚は、主体軸に沿ってパラキシャル中胚を、種固有の間隔、カウント、およびサイズ分布を持つスマイトに順番にセグメント化します。種内の個々の胚の間でこのような堅牢性にもかかわらず、脊椎動物種の間ではスマイトセグメンテーションが汎用性が高い。セグメンテーションは、時間間隔の広大な管理(ゼブラフィッシュの25分からヒトでは5時間まで)、サイズ(ゼブラフィッシュの尾節からマウスの幹スマイトで〜200μmまで)およびカウント(ゼブラフィッシュの32からトウモロコシヘビの〜300まで)2で起こる。さらに興味深いことに、魚の胚は、セグメンテーション間隔と軸伸び速度の両方を補うことによって、適切なサイズの分布でスマイトをそのまま維持しながら、幅広い温度(ゼブラフィッシュでは約20.5°Cから34°Cまで)で発達することができます。このような興味深い特徴を超えて、ゼブラフィッシュは、兄弟胚の豊かさの外部、同期的、透明な発達だけでなく、そのアクセス可能な遺伝的ツールのために脊椎動物のセグメンテーションを研究するのに有用なモデル生物として残ります。顕微鏡の観点から悪いことに、テレオスト胚はかさばる球状の黄身上で発達し、その周りの胃組織を伸ばし丸める(図1A)。本稿では、ゼブラフィッシュの尾に対する平坦化された3次元組織外植培養を紹介する。この外植体系は、黄身質量の球面制約を回避し、スマイトパターニングのための魚の胚の高解像度のライブイメージングへのアクセスを可能にする。
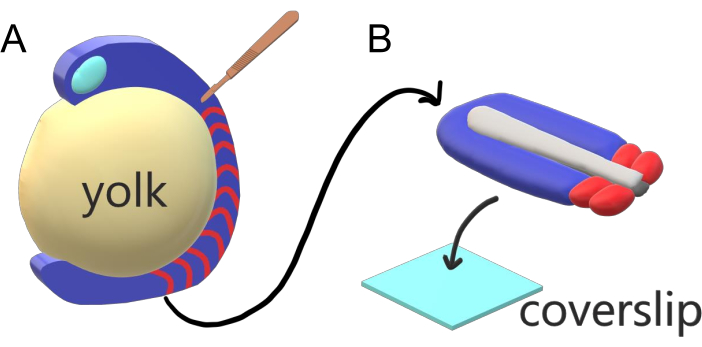
図1:ゼブラフィッシュ胚用スライドチャンバー外植システム(A)ゼブラフィッシュ胚は、胚組織(青)の透明化などの生画像化に有利であるが、組織は、無傷の胚におけるほぼ客観的で高解像度のイメージングを防ぐ、かさばる球状黄身塊(黄色)の周りに形成される。尾部の外植は、スマイトの組織前部(赤)から切り取られ、後部の黄身との境界で続くマイクロサージカルナイフ(茶色)で解剖することができる。(B)解剖された尾の外植はカバースリップ(水色)のドーソベントラリーに置くことができる。神経組織(明るい灰色)を上に、脊索(濃い灰色)を底に保ちます。この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
この記事では、ゼブラフィッシュ胚のために最近開発し、使用した組織培養外植技術の詳細なプロトコルを提示します。私たちの技術は、ひよこ8とゼブラフィッシュ9、10、11モデル生物の以前の外植方法に基づいています。このプロトコルで調製された尾の外植は、単純なスライドチャ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
私たちは、魚のメンテナンスのためのAECOMゼブラフィッシュコア施設とシンシナティ子供獣医サービス、技術的支援のためのシンシナティ子供イメージングコア、ビデオ制作の支援のためのディダルサパロフと原稿を編集するためのハンナシーウォールに感謝します。この出版物で報告された研究は、E.M.Öに賞番号R35GM140805の下で国立衛生研究所の国立一般医学研究所によってサポートされました。コンテンツは著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

