얼룩말피에서 척추동물 세분화를 연구하는 3-D 꼬리 이식 문화
Summary
여기서, 우리는 척추 동물 분할의 라이브 연구를 가능하게, 제브라피시 후방 체축의 3-D 조직 배양에 대한 프로토콜을 제시한다. 이 각성 모델은 축 신장, 형태항원 변형, 세포외 분해능 조직 수준 라이브 이미징에 대한 제어를 제공합니다.
Abstract
척추 동물 배아는 반복적인 솜투, 척추, 근육 및 피부의 선구자로서 주요 신체 축을 패턴으로 합니다. 소마이트는 배아의 꼬리 끝이 후방으로 길게 하는 동안 전소성 중구(PSM)로부터 점진적으로 분과한다. 소미트는 정기적인 주기율과 크기가 크기가 있는 형태를 이룹니다. Zebrafish는 유전적으로 유전적으로 견딜 수 있고 살아있는 화상 진찰을 허용하는 투명한 배아를 가지고 있기 때문에 인기있는 모델 유기체입니다. 그럼에도 불구하고, somitogenesis 동안, 물고기 배아는 크고 둥근 노른자 주위에 싸여 있습니다. 이 기하학은 특히 가까운 객관적인 작업 거리를 필요로 하는 더 높은 해상도에서 제브라피시 배아에 있는 PSM 조직의 살아있는 화상 진찰을 제한합니다. 여기서, 우리는 제브라피시 꼬리 의 살아있는 화상 진찰을 위한 평평한 3-D 조직 배양 방법을 제시합니다. 꼬리 는 축 신장의 비례 감속과 로스트로코달 소미트 길이의 단축을 표시하여 그대로 배아를 모방. 우리는 또한 절제 된 문화를 통해 축 신장 속도를 지연 시킬 수 있습니다. 이를 통해 처음으로 축 신장의 기계성 입력에서 신호 그라데이션의 화학적 입력을 풀 수 있습니다. 향후 연구에서, 이 방법은 약물 침투 우려 없이 시간 조절 된 제약 동요 또는 척추 동물 세분화의 검열을 허용 하기 위해 미세 유체 설정과 결합 될 수 있습니다.
Introduction
유기체의 메타메황 세분화는 자연에서 널리 사용됩니다. 반복된 구조물은 바디 계획1에서척추, 근육, 신경, 혈관, 사지 및 잎과 같은 측면 기관의 기능에 필수적입니다. 축 대칭의 이러한 생리적 및 기하학적 제약의 결과로, 아네리드, 절지동물 및 그들의 배아 조직의 초다트 전시 세분화와 같은 Bilateria의 대부분의 필라(예: 자궁 절제술, 중음근) antero-후방.
척추 동물 배아는 주 체축을 따라 종별 간격, 개수 및 크기 분포를 가진 솜투로 순차적으로 분사합니다. 종 내의 개별 적인 태아 중 이러한 견고함에도 불구 하 고, somite 세분화는 척추 동물 종 사이 다재 다능 한. 세분화는 시간 간격의 광대 한 정권에서 발생 (제브라피시에서 25 분에서 5 인간의 시간), 크기 (제브라피시의 꼬리 솜톤의 ~ 20 μm에서 ~200 μm 마우스의 트렁크 솜트에서 ~ 200 μm) 및 카운트 (제브라피시 에서 32에서 ~300 옥수수 뱀에 ~ 300)2. 더 흥미롭게도, 물고기 배아는 세분화 간격과 축 신장 속도 모두에 대해 보상하여 적절한 크기 분포로 소크를 그대로 유지하면서 광범위한 온도 (~20.5 °C에서 얼룩말 피시의 경우 34 °C까지)에서 개발할 수 있습니다. 이러한 흥미로운 특징 외에도 Zebrafish는 외부, 동기 및 형제 배아의 풍요롭고 투명한 발달뿐만 아니라 접근 가능한 유전 도구로 인해 척추 동물의 세분화를 연구하는 유용한 모델 유기체로 유지됩니다. 현미경 관점에서 불리하게, 텔레오스트 배아는 부피가 큰 구형 노른자에서 발전하고, 그 주위의 가스루 조직을 스트레칭하고 반올림한다(그림1A). 이 기사에서는 제브라피시 꼬리에 대한 평평한 3D 조직 식배 문화를 제시합니다. 이 절제 시스템은 노른자 질량의 구형 제약을 우회하여 소미트 패터닝을 위해 물고기 배아의 고해상도 라이브 이미징에 접근할 수 있게 합니다.
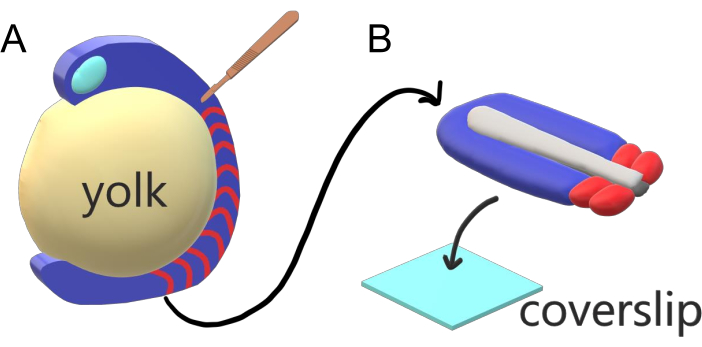
그림 1: 제브라피시 배아용 슬라이드 챔버 엑스플랜트 시스템. (A)제브라피시 배아는 배아 조직(blue)의 투명도와 같은 살아있는 이미징에 장점이 있지만, 부피가 큰 구형 노른자 질량(yellow)을 중심으로 조직이 형성되어 그대로 배아에서 거의 객관적이고 고해상도영상을 방지한다. 꼬리 각질은 소크라이트(빨강)의 조직 전방에서 절단된 미세 수술 칼(brown)으로 시작하여 노른자와 의 국경에서 후불로 계속해낼 수 있다. (B)해부된 꼬리 이출은 커버슬립(라이트 블루)에 등등불구해 배치될 수 있다; 상단에 신경 조직 (밝은 회색)을 유지하고 하단에 notochord (어두운 회색)를 유지합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 문서는 우리가 개발하고 제브라피시 배아를 위해 최근에 사용 된 조직 배양 각기 기술의 상세한 프로토콜을 제시합니다. 우리의 기술은 병아리8과 제브라피시9,10,11 모델 유기체의 이전 각성 방법에 기반을 두고 있습니다. 이 프로토콜로 준비된 꼬리 이식은 간단한 슬라이드 챔버에서 >12h…
Disclosures
The authors have nothing to disclose.
Acknowledgements
AECOM Zebrafish 코어 시설과 신시내티 아동 수의학 서비스, 기술 지원을 위한 신시내티 어린이 이미징 코어, 디다르 사파로프(Didar Saparov) 비디오 제작 지원, 원고 편집을 위한 한나 씨월에게 감사드립니다. 이 간행물에서 보고된 연구는 E.M.Ö에 상 번호 R35GM140805에 국가의 건강 연구소의 일반 의학 과학의 국가 학회에 의해 지원되었습니다. 이 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 나타내는 것은 아닙니다.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

