En 3D Tail Explant Culture för att studera ryggradsdjur segmentering i zebrafisk
Summary
Här presenterar vi protokollet för 3D-vävnadskulturen i zebrafiskens bakre kroppsaxel, vilket möjliggör levande studier av ryggradsdjur segmentering. Denna explant modell ger kontroll över axeln förlängning, förändring av morfogen källor och subcellulära upplösning vävnad nivå levande imaging.
Abstract
Ryggradsdjursembryon mönstrar sin stora kroppsaxel som repetitiva somiter, prekursorerna för ryggkotor, muskler och hud. Somiter gradvis segmenterar från den presomitic mesodermen (PSM) som svanen avslutar av embryot för långsträckter posteriorly. Somiter bildas med regelbunden periodicitet och skala i storlek. Zebrafisk är en populär modellorganism eftersom den är genetiskt kanterbar och har genomskinliga embryon som möjliggör levande avbildning. Ändå, under somitogenesis, är fiskembryon lindade runt en stor, avrundande äggula. Denna geometri begränsar levande avbildning av PSM-vävnad i zebrafiskembryon, särskilt vid högre upplösningar som kräver ett nära objektivt arbetsavstånd. Här presenterar vi en tillplattad 3D-vävnadskulturmetod för levande avbildning av zebrafisksvansexplanter. Svans explanter efterlikna intakta embryon genom att visa en proportionell avmattning av axeln förlängning och förkortning av rostrocaudal somite längder. Vi kan ytterligare stoppa axelförlängningshastigheten genom explantkulturen. Detta gör det för första gången möjligt för oss att reda ut den kemiska ingången till signalgradienter från den mekanistiska ingången till axiell förlängning. I framtida studier kan denna metod kombineras med en mikrofluidisk inställning för att möjliggöra tidskontrollerade farmaceutiska problem eller screening av ryggradsdjur segmentering utan några läkemedel penetration problem.
Introduction
Metameric segmentering av organismer används ofta i naturen. Upprepade strukturer är viktiga för funktionaliteten hos laterala organ som ryggkotor, muskler, nerver, kärl, lemmar eller löv i en kroppsplan1. Som ett resultat av sådana fysiologiska och geometriska begränsningar av axiell symmetri, de flesta phyla av Bilateria-såsom annelider, leddjur och ackord-utställning segmentering av deras embryonala vävnader (t.ex. ectoderm, mesoderm) antero-posteriorly.
Ryggradsdjursembryon segmenterar sekventiellt sin paraxiala mesoderm längs den stora kroppsaxeln till somiter med artspecifika intervall, antal och storleksfördelningar. Trots sådan robusthet bland enskilda embryon inom en art är somitsegmentering mångsidig mellan ryggradsdjur. Segmentering sker i en stor regim av tidsintervall (från 25 min i zebrafisk till 5 h hos människor), storlekar (från ~ 20 μm i svans somiter av zebrafisk till ~ 200 μm i stam somiter av möss) och räknas (från 32 i zebrafisk till ~ 300 i majsormar)2. Mer intressant är att fiskembryon kan utvecklas i ett brett spektrum av temperaturer (från ~ 20,5 ° C upp till 34 ° C för zebrafisk) samtidigt som de håller sina somiter intakta med rätt storleksfördelningar genom att kompensera för både segmenteringsintervall och axiella förlängningshastigheter. Utöver sådana intressanta egenskaper stannar zebrafisk som en användbar modellorganism för att studera segmentering i ryggradsdjur på grund av den externa, synkrona och transparenta utvecklingen av en plenitude av syskonembryon samt deras tillgängliga genetiska verktyg. Ur ett mikroskopiskt perspektiv utvecklas teleostembryon på en skrymmande sfärisk äggula, som sträcker och rundar den gastrulerande vävnaden runt den (figur 1A). I den här artikeln presenterar vi en tillplattad 3D-vävnad explant kultur för zebrafisk svansar. Detta explantsystem kringgår de sfäriska begränsningarna av äggula massa, vilket ger tillgång till högupplöst levande avbildning av fisk embryon för somite mönstring.
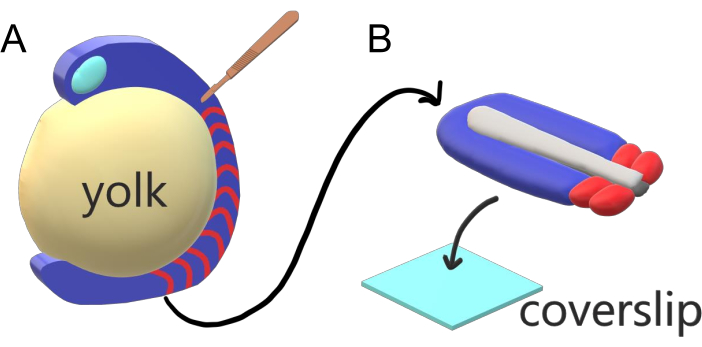
Figur 1:Slide Chamber Explant System for Zebrafish Embryos. (A) Zebrafiskembryon har fördelar för levande avbildning, såsom insyn i gastrulaterande embryonal vävnad (blå), men vävnaden bildas runt en skrymmande sfärisk äggulamassa (gul) som förhindrar nära objektiv, högupplöst avbildning i intakta embryon. Svans explanter kan dissekeras börjar med en mikrokirurgisk kniv (brun) skuren från vävnaden främre av somiter (röd) och fortsätter vid gränsen till äggulan bakre. B)Dissekerade svansexplanter kan placeras på ett täckglas (ljusblått) dorsoventrally. hålla neural vävnad (ljusgrå) på toppen och notochord (mörkgrå) längst ner. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
Denna artikel presenterar ett detaljerat protokoll av en vävnad kultur explant teknik vi utvecklat och använt nyligen5 för zebrafisk embryon. Vår teknik bygger på de tidigare explantmetoderna hos kyckling8 och zebrafisk9,10,11 modellorganismer. Svans explanter som utarbetats med detta protokoll kan överleva så länge som >12 h i en enkel glidkammare, fortsätter att förlän…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar AECOM Zebrafish Core Facility och Cincinnati Children’s Veterinary Services för fiskunderhåll, Cincinnati Children’s Imaging Core för teknisk hjälp, Didar Saparov för hjälp med videoproduktion och Hannah Seawall för redigering av manuskriptet. Forskning som rapporterades i denna publikation stöddes av National Institute of General Medical Sciences vid National Institutes of Health under Award Number R35GM140805 till E.M.Ö. Innehållet är enbart författarnas ansvar och representerar inte nödvändigtvis de nationella hälsoinstitutens officiella åsikter.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

