En 3D Tail Explant Kultur til undersøgelse hvirveldyr Segmentering i zebrafisk
Summary
Her præsenterer vi protokollen for 3D-vævskulturen af zebrafiskens bageste kropsakse, der muliggør levende undersøgelse af hvirveldyrsegmentering. Denne explant model giver kontrol over akse forlængelse, ændring af morfogen kilder, og subcellulær opløsning væv-niveau levende billeddannelse.
Abstract
Hvirveldyr embryoner mønster deres vigtigste krop akse som gentagne somites, forløberne for ryghvirvler, muskler og hud. Somites gradvist segment fra den presomitiske mesoderm (PSM) som enden af embryoet forlænger posteriorly. Somites form med regelmæssig periodicitet og skala i størrelse. Zebrafisk er en populær modelorganisme, da den er genetisk tractable og har gennemsigtige embryoner, der giver mulighed for levende billeddannelse. Ikke desto mindre er fiskefostre viklet rundt om en stor, afrundende æggeblomme under somitogenese. Denne geometri begrænser levende billeddannelse af PSM-væv i zebrafiskembryoner, især ved højere opløsninger, der kræver en tæt objektiv arbejdsafstand. Her præsenterer vi en flad 3D-vævskulturmetode til levende billeddannelse af zebrafiskhale explants. Hale explants efterligne intakte embryoner ved at vise en proportional afmatning af aksen forlængelse og afkortning af rostrocaudal somite længder. Vi er yderligere i stand til at stall akse forlængelse hastighed gennem explant kultur. Dette gør det for første gang muligt for os at udrede den kemiske tilførsel af signalgradienter fra den mekanistiske tilførsel af aksial forlængelse. I fremtidige undersøgelser kan denne metode kombineres med en mikrofluidisk opsætning for at muliggøre tidskontrollerede farmaceutiske miksninger eller screening af segmentering af hvirveldyr uden problemer med lægemiddelindtrængning.
Introduction
Metamerisk segmentering af organismer er meget udbredt i naturen. Gentagne strukturer er afgørende for funktionaliteten af laterale organer som hvirvler, muskler, nerver, fartøjer, lemmer eller blade i en kropsplan1. Som et resultat af sådanne fysiologiske og geometriske begrænsninger af den aksiale symmetri udviser de fleste karinaer af Bilateria- såsom annelider, leddyr og akkordater-udstilling segmentering af deres embryonale væv (f.eks. ectoderm, mesoderm) antero-posteriorly.
Hvirveldyr embryoner sekventielt segment deres paraxial mesoderm langs de store organ akse i somites med artsspecifikke intervaller, tæller, og størrelse distributioner. På trods af en sådan robusthed blandt individuelle embryoner inden for en art er somitsegmentering alsidig mellem hvirveldyrarter. Segmentering sker i et stort regime af tidsintervaller (fra 25 min i zebrafisk til 5 timer hos mennesker), størrelser (fra ~ 20 μm i hale somites af zebrafisk til ~ 200 μm i trunk somites af mus) og tæller (fra 32 i zebrafisk til ~ 300 i majsslanger)2. Mere interessant er det, at fiskefostre kan udvikle sig i en lang række temperaturer (fra ~20,5 °C op til 34 °C for zebrafisk), samtidig med at deres somitter bevares med korrekt størrelsesfordeling ved at kompensere for både segmenteringsintervaller og aksiale forlængelseshastigheder. Ud over sådanne interessante træk forbliver zebrafisk som en nyttig modelorganisme til at studere segmentering i hvirveldyr på grund af den eksterne, synkrone og gennemsigtige udvikling af en mangfoldighed af søskendefostre samt deres tilgængelige genetiske værktøjer. Fra mikroskopisk perspektiv udvikler teleostembryoner sig på en voluminøs sfærisk æggeblomme, der strækker sig og afrunder det gastrulerende væv omkring det(figur 1A). I denne artikel præsenterer vi en flad 3-D vævsudgravningskultur til zebrafiskhaler. Dette strålesystem omgår æggeblommemassens sfæriske begrænsninger, hvilket giver adgang til levende billeddannelse af fiskeembryoner i høj opløsning med henblik på somite-mønstre.
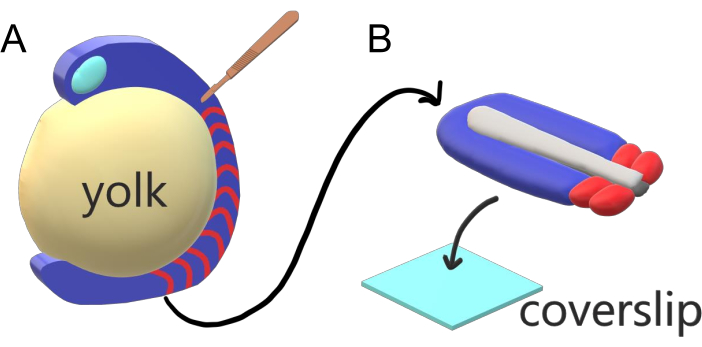
Figur 1: Slide Chamber Explant System for Zebrafish Embryos. (A) Zebrafiskembryoner har fordele for levende billeddannelse, såsom gennemsigtigheden af gastrulerende embryonalt væv (blåt), men vævet dannes omkring en voluminøs sfærisk æggeblommemasse (gul), som forhindrer næsten objektiv billeddannelse i høj opløsning i intakte embryoner. Hale explants kan dissekeres begyndende med en mikrokirurgisk kniv (brun) skåret fra vævet foran somites (rød) og fortsætter ved grænsen til æggeblommen posteriorly. (B) Dissekerede hale explants kan placeres på en coverslip (lyseblå) dorsoventrally; holde neuralt væv (lysegrå) på toppen og notochord (mørkegrå) i bunden. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Denne artikel præsenterer en detaljeret protokol over en vævskultur explant teknik, vi udviklede og brugte for nylig5 til zebrafisk embryoner. Vores teknik bygger på de tidligere explant metoder i chick8 og zebrafish9,10,11 model organismer. Hale explants udarbejdet med denne protokol kan overleve, så længe > 12 timer i en simpel dias kammer, fortsætter med at forlænge sin s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker AECOM Zebrafish Core Facility og Cincinnati Children’s Veterinary Services for fiskevedligeholdelse, Cincinnati Children’s Imaging Core for teknisk bistand, Didar Saparov for hjælp til videoproduktion og Hannah Seawall for at redigere manuskriptet. Forskning rapporteret i denne publikation blev støttet af National Institute of General Medical Sciences af National Institutes of Health under Award Number R35GM140805 til E.M.Ö. Indholdet er udelukkende forfatternes ansvar og repræsenterer ikke nødvendigvis de nationale sundhedsinstitutters officielle synspunkter.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
References
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Developmental Biology. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

