الجزيئية الربيع التحليل المستمر من قبل التحليل الطيفي قوة قوة Biomembrane
Summary
مسبار قوة الوميمبران الحيوي (BFP) هو تقنية التحليل الطيفي للقوة الديناميكية في الموقع (DFS). يمكن استخدام BFP لقياس ثابت الربيع من التفاعلات الجزيئية على الخلايا الحية. يقدم هذا البروتوكول تحليلا ثابتا لفصل الربيع للروابط الجزيئية التي اكتشفها BFP.
Abstract
وقد برز مؤخرا مسبار قوة الوميمبران الحيوي (BFP) كسطح الخلية الأصلية أو في الموقع التحليل الطيفي للقوة الديناميكية (DFS) nanotool التي يمكن قياس الحركية ملزمة جزيئية واحدة، وتقييم الخصائص الميكانيكية للتفاعلات مستقبلات ليجاند، تصور التغيرات تشكيلية ديناميكية البروتين ومستقبلات أكثر إثارة توضيح آليات mechanosensing الخلية بوساطة. وفي الآونة الأخيرة، تم استخدام BFP لقياس ثابت الربيع من الروابط الجزيئية. يصف هذا البروتوكول الإجراء خطوة بخطوة لإجراء تحليل DFS ثابت الربيع الجزيئي. على وجه التحديد، يتم مناقشة وضعي تشغيل BFP، وهما أوضاع خلية الخرز والخرز. يركز هذا البروتوكول على اشتقاق ثوابت الربيع للروابط الجزيئية والخلايا من البيانات الخام DFS.
Introduction
كما تقنية DFS الخلايا الحية، BFP المهندسين خلية الدم الحمراء البشرية (RBC؛ 1000000000000000000000000000000000000000000 الشكل 1) إلى محول قوة فائق الحساسية وغير قادر مع مجموعة ثابتة ربيعية متوافقة عند 0.1-3 pN/nm1،2،3. للتحقيق في التفاعل بين مستقبلات ليغاند، BFP تمكن قياسات DFS في ~ 1 pN (10-12 N)، ~ 3 نانومتر (10-9 م)، و ~ 0.5 مللي ثانية (10-3 ثانية) في القوة والمكانية، والقرار الزمني4،5. يتكون تكوينه التجريبي من اثنين من micropipettes المتعارضة ، وهي التحقيق والهدف. التحقيق micropipette aspirates RBC ولصق حبة في ذروتها عن طريق التفاعل البيوتين streptavidin. الخرزة مغلفة مع ليغاند من الفائدة (الشكل 1A). الهدف micropipette aspirates إما خلية أو حبة تحمل مستقبلات الاهتمام ، المقابلة لخلية الخرز(الشكل 1B)والخرزة حبة (الشكل 1C) وسائط ، على التوالي5.
وقد وصفت BFP البناء والتجميع والبروتوكولات التجريبية DFS بالتفصيل سابقا1،6. باختصار، دورة لمسة BFP يتكون من 5 مراحل: نهج، Impinge، الاتصال، تراجع وتفكك(الشكل 1D). ويشار إلى موقف قمة RBC الأفقي على أنه ΔxRBC. في البداية، تشوه RBC غير المجهد (قوة الصفر) هو 0 ( الجدول 1). ثم يتم دفع الهدف من قبل piezotranslator إلى impinge على وتراجع من حبة التحقيق(الشكل 1D). يتم ضغط أول مسبار RBC من قبل الهدف مع تشوه RBC السلبي ΔxRBC < 0. في حدث بوند، تنتقل مرحلة التراجع من مرحلة ضغط إلى مرحلة الشد مع تشوه RBC الإيجابي ΔxRBC > 0 (الشكل 2C و D). وفقا لقانون هوك، فإن قوة تحمل BFP قادرة على أن تقاس على أنها F = kRBC × ΔxRBC، حيث KRBC ( الجدول1) هو ثابت الربيع RBC من BFP. عند تمزق السندات والانتهاء من دورة لمسة واحدة، يعود حبة التحقيق إلى موقف قوة الصفر مع ΔxRBC = 0(الشكل 1D).
لتحديدRBC ك، ونحن قياس وتسجيل شعاعي من فتحة التحقيق micropipette الداخلية (ص ر)، وRBC (R0) ومنطقة الاتصال الدائري (Rج) بين RBC والخرزة التحقيق ( الشكل1A). ثم يتمحساب كRBC وفقا لنموذج ايفان (Eq. 1)7،8 باستخدام برنامج LabVIEW الذي يعمل كأداة افتراضية (VI) لتشغيل BFP ( الشكلS1A)8،9.
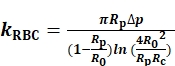 (Eq. 1)
(Eq. 1)
مع BFP المنشأة وDFS البيانات الخام التي تم الحصول عليها، وهنا نقدم كيفية تحليل ثابت الربيع من زوج مستقبلات ليجند أو الخلايا. البيانات الخام DFS على التفاعل بين البروتين الجليكوسيلات Thy-1 و K562 خلية تحمل integrin α5β1 (Thy-1-α5β1; الشكلان 3A و 3B)10 و 10 من الفيبرينوجين والخرز المغلفة integrin αIIbβ3 (FGN-αIIbβ3; الشكل 3C) 11,12 وقد استخدمت لإثبات الخرز الخلية والخرز حبة وسائط التحليل, على التوالي.
BFP التحضير التجريبي
للحصول على تفاصيل إعداد BFP التجريبي والأجهزة، يرجى الرجوع إلى البروتوكولات المنشورة سابقا3. وباختصار، تم تطين RBC البشري باستخدام البيوتين-PEG3500-NHS في العازلة الكربون/ بيكربونات. وقد اقترنت البروتينات ذات الأهمية بشكل مشترك بالخرز الزجاجي البوروسيليكات باستخدام MAL-PEG3500-NHS في حاجز الفوسفات. لإرفاق RBC البيوتينية ، يتم أيضا طلاء حبة المسبار بالستريبتافيدين (SA) باستخدام MAL-SA. يرجى الاطلاع على جدول المواد والجدول 2.
لتجميع BFP (الشكل 1، إلى اليسار) ، سيتم استخدام micropipette الثالثة التي يطلق عليها “المساعد” لتسليم حبة التحقيق والغراء إلى قمة RBC1،3. التفاعل التساهمي بين حبة التحقيق المغلفة SA وRBC البيوتينية هو أقوى بكثير من رابطة مستقبلات ليغاند من الفائدة. وهكذا، يمكن تفسير المرحلة التفككية على أنها تمزق السندات مستقبلات ليغاند بدلا من مفرزة من حبة التحقيق من RBC.
Protocol
Representative Results
Discussion
باختصار ، قدمنا بروتوكول تحليل بيانات مفصل للمعالجة المسبقة للبيانات الخام DFS واشتقاق ثوابت الربيع الجزيئية في أوضاع تحليل BFP Bead-Bead و Bead-Cell. يتم تقديم نماذج ومعادلات الميكانيكا الحيوية اللازمة لتحديد ثوابت الربيع الجزيئية والخلوية. وإن كانت تدرس integrins مختلفة ، وkمول تقاس وضع حبة…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر غيوم ترواديك على المناقشة المفيدة، وزيهاو وانغ على استشارة الأجهزة، ومركز سيدني للتصنيع، وجريج سوانينغ وسيمون رينغر لدعمهم شركتنا الناشئة في المختبر. تم دعم هذا العمل من قبل مشروع اكتشاف مجلس البحوث الأسترالي (DP200101970 – L.A.J.) ، وبرنامج بناء قدرات القلب والأوعية الدموية في نيو ساوث ويلز (منحة الباحث الوظيفي في منتصف مبكر – L.A.J.) ، جائزة مسرع أبحاث سيدني (SOAR – L.A.J.) ، مؤسسات راماسيوتي منحة الاستثمار الصحي (2020HIG76 – L.A.J.) ، ومنحة أفكار المجلس الوطني للصحة والبحوث الطبية (APP2003904 – L.A.J.) ، وصندوق جامعة سيدني للشركات الناشئة في كلية الهندسة ومخطط المعدات الرئيسية (L.A.J.). بطانة أرنولد جو هو زميل مجلس البحوث الأسترالي DECRA (DE190100609).
Materials
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct, Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| BFP data acquisition VI | LabVIEW | BFP control and parameter setting | |
| BFP data analysis VI | LabVIEW | BFP raw data analysis | |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Borosilicate Glass beads | Distrilab Particle Technology, Netherlands | 9002 | Glass bead functionalization |
| Bovine serum albumin | Sigma-Aldrich | A0336 | Ligand functionalization |
| Camera VI | LabVIEW | BFP monitoring | |
| D-glucose | Sigma-Aldrich | G7021 | Tyrode’s buffer preparation |
| Hepes | Sigma-Aldrich | H3375 | Tyrode’s buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Glass bead functionalization |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tyrode’s buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation; Tyrode’s buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tyrode’s buffer preparation |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4•H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Streptavidin-Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
References
- Chen, Y., et al. Fluorescence Biomembrane Force Probe: Concurrent Quantitation of Receptor-ligand Kinetics and Binding-induced Intracellular Signaling on a Single Cell. The Journal of Visualized Experiments. (102), e52975 (2015).
- Su, Q. P., Ju, L. A. Biophysical nanotools for single-molecule dynamics. Biophysics Reviews. 10 (5), 1349-1357 (2018).
- Ju, L. Dynamic Force Spectroscopy Analysis on the Redox States of Protein Disulphide Bonds. Methods in Molecular Biology. 1967, 115-131 (2019).
- An, C., et al. Ultra-stable Biomembrane Force Probe for Accurately Determining Slow Dissociation Kinetics of PD-1 Blockade Antibodies on Single Living Cells. Nano Letters. 20 (7), 5133-5140 (2020).
- Chen, Y., Ju, L., Rushdi, M., Ge, C., Zhu, C. Receptor-mediated cell mechanosensing. Molecular Biology of the Cell. 28 (23), 3134-3155 (2017).
- Ju, L., Chen, Y., Rushdi, M. N., Chen, W., Zhu, C. Two-Dimensional Analysis of Cross-Junctional Molecular Interaction by Force Probes. Methods in Molecular Biology. 1584, 231-258 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical Journal. 68 (6), 2580-2587 (1995).
- Ju, L., Zhu, C. Benchmarks of Biomembrane Force Probe Spring Constant Models. Biophysical Journal. 113 (12), 2842-2845 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysical Journal. 68, 2580 (1995).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature Communications. 5, 4886 (2014).
- Passam, F., et al. Mechano-redox control of integrin de-adhesion. Elife. 7, (2018).
- Chen, Y., et al. An integrin alphaIIbbeta3 intermediate affinity state mediates biomechanical platelet aggregation. Nature Materials. 18 (7), 760-769 (2019).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60, 70-85 (2017).
- Liu, B., Chen, W., Zhu, C. Molecular force spectroscopy on cells. Annual Review of Physical Chemistry. 66, 427-451 (2015).
- Piper, J. W., Swerlick, R. A., Zhu, C. Determining force dependence of two-dimensional receptor-ligand binding affinity by centrifugation. Biophysical Journal. 74 (1), 492-513 (1998).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal flanking region of the A1 domain regulates the force-dependent binding of von Willebrand factor to platelet glycoprotein Ibα. Journal of Biological Chemistry. 288 (45), 32289-32301 (2013).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. Elife. 5, 15447 (2016).

