Molekylær fjeder konstant analyse af Biomembrane Force Probe spektroskopi
Summary
En biomembrankraftsonde (BFP) er en in situ dynamic force spektroskopi (DFS) teknik. BFP kan bruges til at måle fjederkonstanten af molekylære interaktioner på levende celler. Denne protokol præsenterer foråret konstant analyse for molekylære obligationer opdaget af BFP.
Abstract
En biomembrane force probe (BFP) har for nylig vist sig som en indfødt celle-overflade eller in situ dynamisk kraft spektroskopi (DFS) nanotool, der kan måle enkelt-molekylær bindende kinetikere, vurdere mekaniske egenskaber ligand-receptor interaktioner, visualisere protein dynamisk kropsbygning ændringer og mere spændende belyse receptor medieret celle mekanosensing mekanismer. For nylig er BFP blevet brugt til at måle forårskonstanten af molekylære bindinger. Denne protokol beskriver den trinvise procedure til at udføre molekylær fjederkonstant DFS-analyse. Specifikt diskuteres to BFP-driftstilstande, nemlig perlecelle- og perleperletilstandene. Denne protokol fokuserer på at udlede fjederkonstanter af molekylærbindingen og cellen fra DFS-rådata.
Introduction
Som en live-celle DFS teknik, BFP ingeniører en menneskelig rød blodlegemer (RBC; Figur 1) til en ultrafølsom og tunable krafttransducer med et kompatibelt fjederkonstantområde ved 0,1-3 pN/nm1,2,3. For at sondere ligand-receptor interaktion, BFP muliggør DFS målinger på ~ 1 pN (10-12 N), ~ 3 nm (10-9 m), og ~ 0,5 ms (10-3 s) i kraft, rumlig og tidsmæssig opløsning4,5. Dens eksperimentelle konfiguration består af to modsatrettede mikropipetter, nemlig sonden og målet. Probe mikropipetten aspireerer en RBC og en perle er limet på sit højdepunkt via en biotin-streptavidin interaktion. Perlen er belagt med ligand af interesse (figur 1A). Target-mikropipetten aspireerer enten en celle eller en perle, der bærer receptoren af interesse, svarende til perlecelle –figur 1B) og perleperle (Figur 1C) tilstande, henholdsvis5.
BFP konstruktion, samling og DFS eksperimentelle protokoller blev beskrevet i detaljer tidligere1,6. Kort fortalt består en BFP-berøringscyklus af 5 faser: Tilgang, Hindring, Kontakt, Tilbagetrækning og Dissociate (Figur 1D). Den vandrette RBC-spidsposition er angivet som ΔxRBC. I begyndelsen er den ustrøede (nul-kraft) RBC deformation ΔxRBC 0 (Tabel 1). Målet køres derefter af en piezotranslator for at gribe ind og trække sig tilbage fra sondeperen (Figur 1D). RBC-sonden komprimeres først af Target med negativ RBC-deformation ΔxRBC < 0. I en Bond-hændelse skifter tilbagetrækningsstadiet fra et kompressivt til en trækfase med positiv RBC-deformation ΔxRBC > 0 (Figur 2C og D). Ifølge Hookes lov kan BFP’s bærekraft måles som F = kRBC × ΔxRBC, hvor kRBC ( tabel1) er BFP’s RBC-fjederkonstant. Ved lim brud og afslutningen af en touch cyklus, sonden perle vender tilbage til nul-kraft position med ΔxRBC = 0 (Figur 1D).
For at bestemme kRBCmåler og registrerer vi radierne i sondemikropipettens indre åbning (Rp), RBC (R0) og det cirkulære kontaktområde (Rc) mellem RBC og sondeperen ( Figur1A). Derefter beregnes kRBC i henhold til Evans model (Eq. 1)7,8 ved hjælp af et LabVIEW-program, der fungerer som et virtuelt instrument (VI) til at betjene BFP ( FigurS1A)8,9.
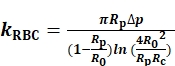 (Eq. 1)
(Eq. 1)
Med en BFP etableret og DFS rå data opnået, hermed præsenterer vi, hvordan man analyserer foråret konstant af ligand-receptor par eller celler. DFS-rådata om samspillet mellem det glycosylerede protein Thy-1 og K562-cellen med integrin α5β1 (Thy-1-α5β1; Figur 3A og 3B)10 og fibrinogen og perlebelagt integrin αIIbβ3 (FGN-αIIbβ3; Figur 3C) 11,12 er blevet brugt til at demonstrere henholdsvis perlecelle- og perleperleanalysetilstandene.
BFP eksperimentel forberedelse
Yderligere oplysninger om BFP’s eksperimentelle forberedelse og instrumentering henvises til de tidligere offentliggjorte protokoller3. Kort sagt er human RBC blevet biotinyleret ved hjælp af Biotin-PEG3500-NHS i kulstof /bicarbonatbufferen. Proteiner af interesse er blevet kovalent koblet til borosilicate glasperler ved hjælp af MAL-PEG3500-NHS i fosfat buffer. For at fastgøres til den biotinylerede RBC er sondeperen også belagt med streptavidin (SA) ved hjælp af MAL-SA. Se tabellen over materialer og tabel 2.
For at samle BFP(figur 1, til venstre)vil den tredje mikropipette , der kaldes ‘Hjælper’, blive brugt til at levere sondeperen og lime den fast til RBC’s spids1,3. Den kovalente interaktion mellem sa-coated sondeper og biotinyleret RBC er meget stærkere end ligandreceptorbindingen af interesse. Således kan Dissociate-stadiet fortolkes som ligand-receptorbindingsbrud snarere end løsrivelse af Probe perle fra RBC.
Protocol
Representative Results
Discussion
Sammenfattende har vi leveret en detaljeret dataanalyseprotokol til forbehandling af DFS-rådata og udlede molekylære fjederkonstanter i BFP Bead-Bead- og Perlecelleanalysetilstandene. Biomekaniske modeller og ligninger, der kræves til bestemmelse af molekylære og cellulære fjederkonstanter præsenteres. Selvom forskellige integriner studeres, har kmol målt ved Perle-Perle-tilstanden og Perlecelletilstanden betydelige rækkeviddeforskelle (Figur 3A vs. <strong class=…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Guillaume Troadec for nyttige diskussion, Zihao Wang for hardware høring, og Sydney Manufacturing Hub, Gregg Suaning og Simon Ringer for støtte til vores lab opstart. Dette arbejde blev støttet af Australian Research Council Discovery Project (DP200101970 – L.A.J.), NSW Cardiovascular Capacity Building Program (Early-Mid Career Researcher Grant – L.A.J.), Sydney Research Accelerator-prisen (SOAR – L.A.J.), Ramaciotti Foundations Health Investment Grant (2020HIG76 – L.A.J.), National Health and Medical Research Council Ideas Grant (APP2003904 – L.A.J.) og University of Sydney Faculty of Engineering Startup Fund and Major Equipment Scheme (L.A.J.). Lining Arnold Ju er en australsk Research Council DECRA stipendiat (DE190100609).
Materials
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct, Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| BFP data acquisition VI | LabVIEW | BFP control and parameter setting | |
| BFP data analysis VI | LabVIEW | BFP raw data analysis | |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Borosilicate Glass beads | Distrilab Particle Technology, Netherlands | 9002 | Glass bead functionalization |
| Bovine serum albumin | Sigma-Aldrich | A0336 | Ligand functionalization |
| Camera VI | LabVIEW | BFP monitoring | |
| D-glucose | Sigma-Aldrich | G7021 | Tyrode’s buffer preparation |
| Hepes | Sigma-Aldrich | H3375 | Tyrode’s buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Glass bead functionalization |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tyrode’s buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation; Tyrode’s buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tyrode’s buffer preparation |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4•H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Streptavidin-Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
References
- Chen, Y., et al. Fluorescence Biomembrane Force Probe: Concurrent Quantitation of Receptor-ligand Kinetics and Binding-induced Intracellular Signaling on a Single Cell. The Journal of Visualized Experiments. (102), e52975 (2015).
- Su, Q. P., Ju, L. A. Biophysical nanotools for single-molecule dynamics. Biophysics Reviews. 10 (5), 1349-1357 (2018).
- Ju, L. Dynamic Force Spectroscopy Analysis on the Redox States of Protein Disulphide Bonds. Methods in Molecular Biology. 1967, 115-131 (2019).
- An, C., et al. Ultra-stable Biomembrane Force Probe for Accurately Determining Slow Dissociation Kinetics of PD-1 Blockade Antibodies on Single Living Cells. Nano Letters. 20 (7), 5133-5140 (2020).
- Chen, Y., Ju, L., Rushdi, M., Ge, C., Zhu, C. Receptor-mediated cell mechanosensing. Molecular Biology of the Cell. 28 (23), 3134-3155 (2017).
- Ju, L., Chen, Y., Rushdi, M. N., Chen, W., Zhu, C. Two-Dimensional Analysis of Cross-Junctional Molecular Interaction by Force Probes. Methods in Molecular Biology. 1584, 231-258 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical Journal. 68 (6), 2580-2587 (1995).
- Ju, L., Zhu, C. Benchmarks of Biomembrane Force Probe Spring Constant Models. Biophysical Journal. 113 (12), 2842-2845 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysical Journal. 68, 2580 (1995).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature Communications. 5, 4886 (2014).
- Passam, F., et al. Mechano-redox control of integrin de-adhesion. Elife. 7, (2018).
- Chen, Y., et al. An integrin alphaIIbbeta3 intermediate affinity state mediates biomechanical platelet aggregation. Nature Materials. 18 (7), 760-769 (2019).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60, 70-85 (2017).
- Liu, B., Chen, W., Zhu, C. Molecular force spectroscopy on cells. Annual Review of Physical Chemistry. 66, 427-451 (2015).
- Piper, J. W., Swerlick, R. A., Zhu, C. Determining force dependence of two-dimensional receptor-ligand binding affinity by centrifugation. Biophysical Journal. 74 (1), 492-513 (1998).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal flanking region of the A1 domain regulates the force-dependent binding of von Willebrand factor to platelet glycoprotein Ibα. Journal of Biological Chemistry. 288 (45), 32289-32301 (2013).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. Elife. 5, 15447 (2016).

