Imagerie et analyse automatisées pour la quantification des macropinosomes marqués par fluorescence
Summary
Les essais automatisés utilisant des microplaques multi-puits sont des approches avantageuses pour identifier les régulateurs de voie en permettant l’évaluation d’une multitude de conditions dans une seule expérience. Ici, nous avons adapté le protocole bien établi d’imagerie et de quantification des macropoinosomes à un format de microplaques à 96 puits et fournissons un aperçu complet de l’automatisation à l’aide d’un lecteur de plaques multimode.
Abstract
La macropinocytose est une voie d’absorption de la phase liquidienne non spécifique qui permet aux cellules d’internaliser de grandes cargaisons extracellulaires, telles que des protéines, des agents pathogènes et des débris cellulaires, par endocytose en vrac. Cette voie joue un rôle essentiel dans une variété de processus cellulaires, y compris la régulation des réponses immunitaires et le métabolisme des cellules cancéreuses. Compte tenu de cette importance dans la fonction biologique, l’examen des conditions de culture cellulaire peut fournir des informations précieuses en identifiant les régulateurs de cette voie et en optimisant les conditions à utiliser dans la découverte de nouvelles approches thérapeutiques. L’étude décrit une technique d’imagerie et d’analyse automatisée utilisant un équipement de laboratoire standard et un lecteur de plaques multimode d’imagerie cellulaire pour la quantification rapide de l’indice macropinocytaire dans les cellules adhérentes. La méthode automatisée est basée sur l’absorption de dextran fluorescent de haut poids moléculaire et peut être appliquée à des microplaques de 96 puits pour faciliter l’évaluation de plusieurs conditions dans une expérience ou des échantillons fixes montés sur des couvercles en verre. Cette approche vise à maximiser la reproductibilité et à réduire la variation expérimentale tout en étant à la fois rapide et rentable.
Introduction
La voie endocytaire non spécifique de la macropinocytose permet aux cellules d’internaliser une variété de composants extracellulaires, y compris les nutriments, les protéines, les antigènes et les agents pathogènes, grâce à l’absorption en vrac du liquide extracellulaire et de ses constituants1. Bien qu’importante pour la biologie de nombreux types de cellules, la voie de la macropinocytose est décrite comme jouant un rôle essentiel dans la biologie tumorale, où, grâce à l’absorption macropinocytaire, les cellules tumorales sont capables de survivre et de proliférer en présence d’un microenvironnement appauvri en nutriments2,3. L’absorption des macromolécules extracellulaires, y compris l’albumine et la matrice extracellulaire, et des débris cellulaires nécrotiques, fournit une source alternative de nutriments pour la production de biomasse en créant des acides aminés, des sucres, des lipides et des nucléotides par le biais du catabolisme de cargaison médié par la fusion de macropinosomes et de lysosomes4,5,6,7,8.
L’induction et la régulation de la macropinocytose sont complexes et peuvent varier en fonction du contexte cellulaire. Jusqu’à présent, plusieurs inducteurs de la macropinocytose ont été identifiés et comprennent des ligands, tels que le facteur de croissance épidermique (EGF), le facteur de croissance dérivé des plaquettes (PDGF), la galectine-3 et Wnt3A9,10,11,12,13. En outre, les conditions de culture qui imitent le microenvironnement tumoral peuvent déclencher l’activation de la voie. Les tumeurs de l’adénocarcinome canalaire pancréatique (PDAC) sont privées de nutriments, en particulier pour l’acide aminé glutamine, ce qui fait que les cellules cancéreuses et les fibroblastes associés au cancer (CAF) dépendent de la macropinocytose pour la survie7,13,14,15. De plus, les stress tumoraux, tels que l’hypoxie et le stress oxydatif, peuvent activer cette voie de piégeage16. En plus des nombreux influenceurs extrinsèques qui peuvent induire la macropinocytose, une variété de voies intracellulaires contrôlent la formation de macropinosomes. La transformation oncogène médiée par Ras est suffisante pour initier la machinerie macropinocytaire, et plusieurs types de cancer présentent une macropinocytose constitutive oncogène pilotée par Ras4,5,9,17. Alternativement, l’activation ras de type sauvage et les voies indépendantes de Ras ont été identifiées pour activer la macropinocytose dans les cellules cancéreuses et les CAF10,11,15,18. L’utilisation de divers modèles in vitro en combinaison avec des traitements inhibiteurs a abouti à l’identification de plusieurs modulateurs de macropinocytose, qui comprennent des échangeurs sodium-hydrogène, la petite GTPase Rac1, la phosphoinositide 3-kinase (PI3K), la kinase activée par p21 (Pak) et la protéine kinase activée par AMP (AMPK)4,13,15 . Cependant, étant donné la multitude de facteurs et de conditions décrits qui régulent la macropinocytose, il est concevable que beaucoup plus de modulateurs et de stimuli restent inconnus. L’identification de nouveaux modulateurs et stimuli peut être facilitée par l’évaluation automatisée d’une multitude de conditions dans une seule expérience. Cette méthodologie peut faire la lumière sur les facteurs impliqués dans la formation de macropoinosomes et peut permettre la découverte de nouvelles petites molécules ou de produits biologiques qui ciblent cette voie.
Ici, nous avons adapté notre protocole précédemment établi pour déterminer l’étendue de la macropinocytose dans les cellules cancéreuses in vitro à un format de microplaque à 96 puits et à une imagerie et une quantification automatisées19,20. Ce protocole est basé sur la microscopie fluorescente, qui est devenue une norme dans le domaine pour déterminer la macropinocytose in vitro et in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Les macropoinosomes peuvent être distingués des autres voies endocytaires par leur capacité à internaliser de grandes macromolécules, telles que le dextran de haut poids moléculaire (c.-à-d. 70 kDa)2,3,4,20,21,22,23. Ainsi, les macropinosomes peuvent être définis par l’absorption de fluorophores fluorophores marqués extracellulairement 70 kDa dextran. En conséquence, les vésicules macropinocytaires se manifestent sous forme d’amas intracellulaires de puncta fluorescents de tailles allant de 0,2 à 5 μm. Ces puncta peuvent être imagés au microscope et ensuite quantifiés pour déterminer l’étendue de la macropinocytose dans la cellule – « l’indice macropinocytaire ».
Dans ce protocole, les étapes essentielles pour visualiser les macropinosomes dans les cellules adhérentes in vitro sur une microplaque de 96 puits et des couvercles à l’aide d’équipements de laboratoire standard sont décrites (Figure 1). En outre, les instructions pour automatiser l’acquisition d’images et la quantification de l’indice macropinocytaire à l’aide d’un lecteur de plaques multimode d’imagerie cellulaire sont fournies. Cette automatisation réduit le temps, les coûts et les efforts par rapport à nos protocoles décrits précédemment19,20. En outre, il évite l’acquisition et l’analyse d’images involontairement biaisées et améliore ainsi la reproductibilité et la fiabilité. Cette méthode peut facilement être adaptée à différents types de cellules ou de lecteurs de plaques ou être utilisée pour déterminer d’autres caractéristiques des macropoinosomes, telles que la taille, le nombre et l’emplacement. La méthode décrite ici est particulièrement adaptée au dépistage des conditions de culture cellulaire qui induisent la macropinocytose, à l’identification de nouveaux modulateurs ou à l’optimisation des concentrations médicamenteuses d’inhibiteurs connus.
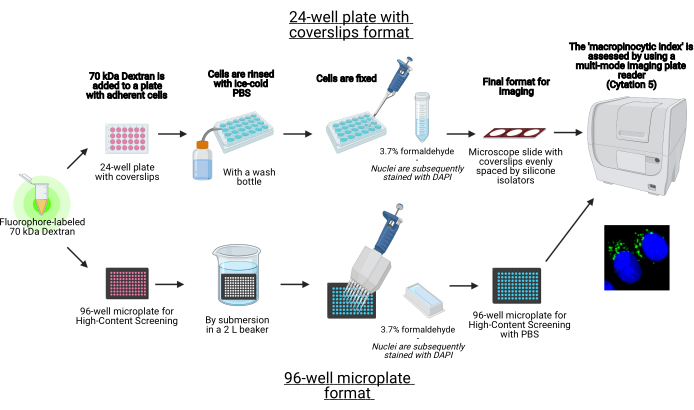
Figure 1 : Schéma du test automatisé pour déterminer l’indice macropinocytaire dans les cellules adhérentes. Créé à l’aide de BioRender. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La qualité des expériences et de l’acquisition des données dépend fortement de la qualité des réactifs, de l’optimisation des réglages et de la propreté des couvercles et des microplaques. Les résultats finaux devraient donner une variation minimale entre les répétitions; cependant, des variations biologiques se produisent naturellement ou peuvent être causées par un certain nombre de facteurs. La densité cellulaire peut amener les cellules à répondre plus ou moins aux inducteurs ou inhibiteurs de la …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par des subventions NIH / NCI (R01CA207189, R21CA243701) à C.C. KMO.G. est récipiendaire d’une bourse postdoctorale TRDRP (T30FT0952). Le BioTek Cytation 5 fait partie du Sanford Burnham Prebys Cell Imaging Core, qui reçoit un soutien financier du NCI Cancer Center Support Grant (P30 CA030199). Les figures 1 à 3 ont été créées à l’aide de BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

