Floresan Etiketli Makropinozomların Nicelleştirilmesi için Otomatik Görüntüleme ve Analiz
Summary
Çok kuyulu mikro plakalar kullanan otomatik tahliller, tek bir deneyde çok sayıda koşulun değerlendirilmesine izin vererek yol düzenleyicilerini tanımlamak için avantajlı yaklaşımlardır. Burada, köklü makropinozom görüntüleme ve niceleme protokolünü 96 kuyulu bir mikro plaka formatına uyarladık ve çok modlu bir plaka okuyucu kullanarak otomasyon için kapsamlı bir anahat sağladık.
Abstract
Makropinositoz, hücrelerin toplu endositoz yoluyla proteinler, patojenler ve hücre kalıntıları gibi büyük hücre dışı kargoları içselleştirmesine izin veren spesifik olmayan bir sıvı fazlı alım yoludur. Bu yol, bağışıklık yanıtlarının düzenlenmesi ve kanser hücresi metabolizması da dahil olmak üzere çeşitli hücresel süreçlerde önemli bir rol oynar. Biyolojik fonksiyondaki bu önem göz önüne alındığında, hücre kültürü koşullarının incelenmesi, bu yolun düzenleyicilerini belirleyerek ve yeni terapötik yaklaşımların keşfinde kullanılacak koşulları optimize ederek değerli bilgiler sağlayabilir. Çalışma, standart laboratuvar ekipmanı kullanılarak otomatik bir görüntüleme ve analiz tekniğini ve yapışık hücrelerdeki makropinositik indeksinin hızlı bir şekilde ölçülmesi için bir hücre görüntüleme çok modlu plaka okuyucusunu tanımlamaktadır. Otomatik yöntem, yüksek moleküler ağırlıklı floresan dektranın alımına dayanır ve cam kapaklara monte edilmiş bir deneyde veya sabit numunelerde birden fazla koşulun değerlendirilmesini kolaylaştırmak için 96 kuyulu mikro plakalara uygulanabilir. Bu yaklaşım, hem zaman kazandıran hem de uygun maliyetli olurken tekrarlanabilirliği en üst düzeye çıkarmayı ve deneysel varyasyonu azaltmayı amaçlamaktadır.
Introduction
Makropinositozun spesifik olmayan endositotik yolu, hücrelerin hücre dışı sıvı ve bileşenlerinin toplu alımı yoluyla besin maddeleri, proteinler, antijenler ve patojenler de dahil olmak üzere çeşitli hücre dışı bileşenleri içselleştirmelerini sağlar1. Çok sayıda hücre tipinin biyolojisi için önemli olsa da, giderek artan bir şekilde, makropinositoz yolunun, makropinositik alım yoluyla tümör hücrelerinin besin tükenmiş bir mikroçevrenin varlığında hayatta kalabildiği ve çoğalabildiği tümör biyolojisinde önemli bir rol oynadığı açıklanmaktadır2,3. Albümin ve hücre dışı matris ve nekrotik hücre kalıntıları da dahil olmak üzere hücre dışı makromoleküllerin alınması, makropinozom ve lizozom füzyon aracılı kargo katabolizması ile amino asitler, şekerler, lipitler ve nükleotidler oluşturarak biyokütle üretimi için alternatif bir besin kaynağı sağlar4,5,6,7,8.
Makropinositozun indüksiyonu ve regülasyonu karmaşıktır ve hücresel içeriğe bağlı olarak değişebilir. Şimdiye kadar, epidermal büyüme faktörü (EGF), trombosit türevi büyüme faktörü (PDGF), galektin-3 ve Wnt3A9,10,11,12,13 gibi çeşitli makropinositoz indükleyicileri tanımlanmıştır ve ligandları içerir. Ek olarak, tümör mikroçevrimini taklit eden kültleme koşulları yolun aktivasyonunu tetikleyebilir. Pankreas düktal adenokarsinom (PDAC) tümörleri, özellikle hem kanser hücrelerine hem de kanserle ilişkili fibroblastlara (CAL) sağkalım için makropinositoza güvenmesine neden olan amino asit glutamin için besinden yoksundur7,13,14,15. Ayrıca, hipoksi ve oksidatif stres gibi tümör stresleri bu atma yolunu aktive edebilir16. Makropinositozu indükleyebilecek çok sayıda dışsal influencer’a ek olarak, çeşitli hücre içi yollar makropinozom oluşumunu kontrol eder. Makropinosik makineleri başlatmak için onkojenik Ras aracılı dönüşüm yeterlidir ve birden fazla kanser türü onkojenik Ras güdümlü konsitültif makropinositoz4,5,9,17 gösterir. Alternatif olarak, kanser hücrelerinde ve CAL’lerde makropinositozu aktive etmek için vahşi tip Ras aktivasyonu ve Ras-bağımsız yollar tanımlanmıştır10,11,15,18. İnhibitör tedavileri ile birlikte çeşitli in vitro modellerin kullanılması, sodyum-hidrojen eşanjörleri, küçük GTPase Rac1, fosfoinositid 3-kinaz (PI3K), p21-aktif kinaz (Pak) ve AMP-aktive protein kinaz (AMPK)4,13,15 içeren çeşitli makropinositoz modülatörlerinin tanımlanmasına neden olmuştur. . Bununla birlikte, makropinositozu düzenleyen tarif edilen faktörlerin ve koşulların çokluğu göz önüne alındığında, daha birçok modülatör ve uyaranın keşfedilmemiş kalması düşünülebilir. Yeni modülatörlerin ve uyaranların tanımlanması, tek bir deneyde çok sayıda koşulun otomatik olarak değerlendirilmesi ile kolaylaştırılabilir. Bu metodoloji makropinozom oluşumunda rol oynayan faktörlere ışık tutabilir ve bu yolu hedefleyen yeni küçük moleküllerin veya biyolojiklerin keşfine izin verebilir.
Burada, in vitro kanser hücrelerinde makropinositozun kapsamını belirlemek için daha önce belirlediğimiz protokolümüzü 96 kuyu mikro plaka formatına ve otomatik görüntüleme ve niceleme19,20’ye uyarladık. Bu protokol, makropinositoz in vitro ve in vivo4,5,6,7,9,10,11,12,13,15,16,17,18 belirlemek için sahada bir standart haline gelen floresan mikroskopiye dayanmaktadır. 19,20,21,22. Makropinozomlar, yüksek moleküler ağırlık dektranı (yani, 70 kDa)2,3,4,20,21,22,23 gibi büyük makromolekülleri içselleştirme yetenekleri sayesinde diğer endosit yollarından ayırt edilebilir. Böylece, makropinozomlar hücre dışı olarak uygulanan florofor etiketli 70 kDa dektran alımı ile tanımlanabilir. Sonuç olarak, makropinositik vesiküller, 0,2-5 μm arasında değişen boyutlara sahip floresan puncta hücre içi kümeler olarak kendini gösterir. Bu puncta mikroskobik olarak görüntülenebilir ve daha sonra hücredeki makropinositozun kapsamını belirlemek için ölçülebilir – ‘makropinositik indeks’.
Bu protokolde, 96 kuyulu bir mikro plaka ve kapaklar üzerinde 96 kuyulu bir mikro plaka ve kapaklar üzerinde yapışan hücre in vitrolarındaki makropinozomları standart laboratuvar ekipmanları kullanılarak görselleştirmek için gerekli adımlar açıklanmıştır (Şekil 1). Buna ek olarak, bir hücre görüntüleme çok modlu plaka okuyucu kullanarak makropinositik indeksin görüntü alımını ve nicelliğini otomatikleştirmek için talimatlar sağlanır. Bu otomasyon, daha önce açıklanan protokollerimize kıyasla zaman, maliyet ve çabayı azaltır19,20. Buna ek olarak, istemeden önyargılı görüntüleme alımını ve analizini önler ve böylece tekrarlanabilirliği ve güvenilirliği arttırır. Bu yöntem, farklı hücre türlerine veya plaka okuyucularına kolayca uyarlanabilir veya boyut, sayı ve konum gibi alternatif makropinozom özelliklerini belirlemek için kullanılabilir. Burada açıklanan yöntem özellikle makropinositozu indükleyen hücre kültürü koşullarının taranması, yeni modülatörlerin tanımlanması veya bilinen inhibitörlerin ilaç konsantrasyonlarının optimizasyonu için uygundur.
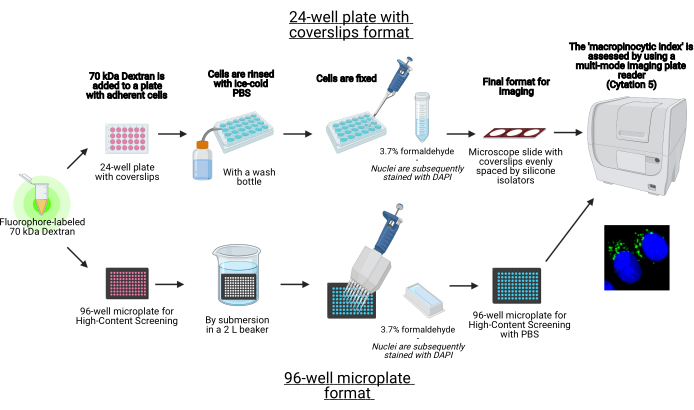
Şekil 1: Yandaş hücrelerdeki ‘makropinositik indeksi’ belirlemek için otomatik tahlil şeması. BioRender kullanılarak oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Deneylerin ve veri toplamanın kalitesi, reaktiflerin kalitesine, ayarların optimizasyonuna ve kapakların ve mikro plakaların temizliğine bağlıdır. Nihai sonuçlar, çoğaltmalar arasında en az varyasyon vermelidir; bununla birlikte, biyolojik varyasyonlar doğal olarak ortaya çıkar veya başka bir şekilde bir dizi faktörden kaynaklanabilir. Hücre yoğunluğu, hücrelerin makropinositoz indükleyicilerine veya inhibitörlerine az çok yanıt vermesine neden olabilir. Bu nedenle, protokolde önerildiği gibi%…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma NIH/NCI hibeleri (R01CA207189, R21CA243701) tarafından C.C. KMO.G.’ye TRDRP Doktora Sonrası Burs Ödülü (T30FT0952) ile desteklenmiştir. BioTek Cytation 5, NCI Kanser Merkezi Destek Hibesi’nden (P30 CA030199) finansal destek alan Sanford Burnham Prebys Hücre Görüntüleme Çekirdeği’nin bir parçasıdır. Şekil 1-3 BioRender kullanılarak oluşturulmuştur.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

