蛍光標識マクロピノソームの定量のための自動イメージングおよび分析
Summary
マルチウェルマイクロプレートを用いた自動アッセイは、単一の実験で多数の条件の評価を可能にすることによって経路調節因子を同定するための有利なアプローチである。ここでは、十分に確立されたマクロピノソームイメージングおよび定量プロトコルを96ウェルマイクロプレート形式に適合させ、マルチモードプレートリーダーを使用した自動化の包括的な概要を提供します。
Abstract
マクロピノサイトーシスは、バルクエンドサイトーシスを介して、細胞がタンパク質、病原体、および細胞破片などの大きな細胞外貨物を内在化させることを可能にする非特異的な液相取り込み経路である。この経路は、免疫応答および癌細胞代謝の調節を含む様々な細胞プロセスにおいて不可欠な役割を果たす。生物学的機能におけるこの重要性を考えると、細胞培養条件を調べることは、この経路の調節因子を特定し、新規治療アプローチの発見に使用される条件を最適化することによって、貴重な情報を提供することができる。この研究は、接着細胞における大ピノサイト指数の迅速な定量化のための標準的な実験装置および細胞イメージングマルチモードプレートリーダーを使用した自動イメージングおよび分析技術について記述している。この自動化方法は、高分子量蛍光デキストランの取り込みに基づいており、96ウェルマイクロプレートに適用して、1回の実験で複数の条件の評価を容易にするか、ガラスカバースリップに取り付けられた固定サンプルを容易にすることができます。このアプローチは、再現性を最大化し、実験の変動を低減しながら、時間を節約し、費用対効果を高めることを目的としています。
Introduction
マクロピノサイトーシスの非特異的なエンドサイトーシス経路は、細胞外液およびその構成成分のバルク取り込みを通じて、細胞が栄養素、タンパク質、抗原、病原体を含む様々な細胞外成分をインターナライズすることを可能にする1。多くの細胞型の生物学にとって重要であるが、マクロピノサイトーシス経路は、マクロピノサイトーシスの取り込みを通じて、腫瘍細胞が栄養枯渇した微小環境の存在下で生存し増殖することができる腫瘍生物学において不可欠な役割を果たすことがますます説明されている2,3。アルブミンおよび細胞外マトリックス、ならびに壊死性細胞破片を含む細胞外巨大分子の取り込みは、マクロピノソームおよびリソソーム融合媒介貨物異化作用を介してアミノ酸、糖、脂質およびヌクレオチドを生成することによってバイオマス生産のための代替栄養源を提供する4,5,6,7,8。
マクロピノサイトーシスの誘導および調節は複雑であり、細胞の状況に応じて変化し得る。これまでに、マクロピノサイトーシスのいくつかの誘導物質が同定されており、リガンド、例えば上皮成長因子(EGF)、血小板由来成長因子(PDGF)、ガレクチン-3、およびWnt3A9、10、11、12、13が含まれる。さらに、腫瘍微小環境を模倣する培養条件は、経路の活性化を誘発し得る。膵管腺癌(PDAC)腫瘍は、特にアミノ酸グルタミンのために栄養を奪われており、癌細胞と癌関連線維芽細胞(CAF)の両方が生存のためにマクロピノサイトーシスに依存する原因となります7,13,14,15。さらに、低酸素症や酸化ストレスなどの腫瘍ストレスは、この消去経路を活性化することができます16。マクロピノサイトーシスを誘導することができる多数の外因性インフルエンサーに加えて、様々な細胞内経路がマクロピノソーム形成を制御する。発癌性Ras媒介形質転換は、マクロピノシー機構を開始するのに十分であり、複数の癌型は発癌性Ras駆動構成的マクロピノサイトーシスを示す4,5,9,17。あるいは、野生型Ras活性化およびRas非依存性経路は、癌細胞およびCAFs10、11、15、18におけるマクロピノサイトーシスを活性化することが同定されている。インヒビター治療と組み合わせた様々なインビトロモデルの使用により、ナトリウム – 水素交換体、小型GTPase Rac1、ホスホイノシチド3-キナーゼ(PI3K)、p21活性化キナーゼ(Pak)、およびAMP活性化プロテインキナーゼ(AMPK)を含むいくつかのマクロピノサイトーシスモジュレーターの同定がもたらされました4,13,15.しかし、マクロピノサイトーシスを調節する多数の記載された因子および条件を考えると、さらに多くのモジュレーターおよび刺激が未発見のままであると考えられる。新規モジュレーターおよび刺激の同定は、単一の実験における多数の条件の自動評価によって促進され得る。この方法論は、マクロピノソーム形成に関与する因子に光を当てることができ、この経路を標的とする新規小分子または生物製剤の発見を可能にする可能性がある。
ここでは、インビトロで癌細胞におけるマクロピノサイトーシスの程度を決定するための以前に確立されたプロトコルを96ウェルマイクロプレート形式に適合させ、自動化されたイメージングおよび定量化19,20。このプロトコールは蛍光顕微鏡法に基づいており、これはインビトロおよびインビボでマクロピノサイトーシスを決定する分野で標準となっている4、5、6、7、9、10、11、12、13、15、16、17、18、 19,20,21,22。マクロピノソームは、高分子量デキストラン(すなわち、70kDa)2、3、4、20、21、22、23などの大きな巨大分子をインターナライズする能力を介して、他のエンドサイトーシス経路と区別することができる。したがって、マクロピノソームは、細胞外投与されたフルオロフォア標識70kDaデキストランの取り込みによって定義することができる。その結果、大ピノサイト小胞は、0.2〜5μmの大きさの蛍光穿刺の細胞内クラスターとして現れる。これらの穿刺を顕微鏡で画像化し、続いて定量化して、細胞内のマクロピノサイトーシスの程度(「マクロピノサイト指数」)を決定することができる。
このプロトコルでは、標準的な実験装置を使用して、96ウェルマイクロプレートおよびカバースリップ上に接着細胞中のマクロピノソームをインビトロで視覚化するための重要な手順が説明されています(図1)。加えて、細胞イメージングマルチモードプレートリーダーを用いたマクロピノサイト指数の画像取得および定量化を自動化するための指示が提供される。この自動化により、前述のプロトコルと比較して、時間、コスト、労力が削減されます19,20。さらに、意図せずに偏った画像の取得と分析を回避し、再現性と信頼性を向上させます。この方法は、異なる細胞型またはプレートリーダーに容易に適合させることができ、またはサイズ、数、および位置などの代替マクロピノソーム特徴を決定するために利用することができる。本明細書に記載の方法は、マクロピノサイトーシスを誘導する細胞培養条件のスクリーニング、新規モジュレーターの同定、または既知の阻害剤の薬物濃度の最適化に特に適している。
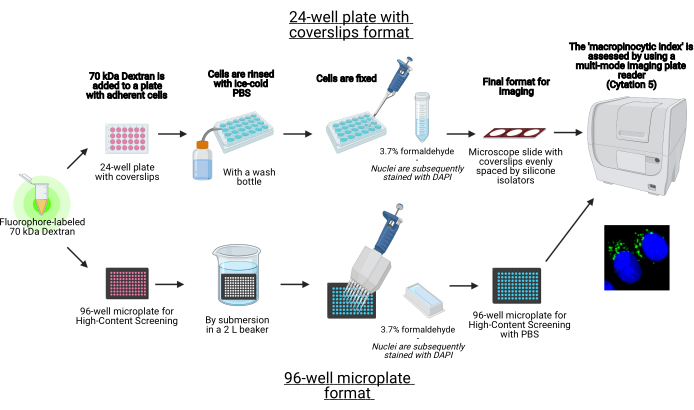
図1:接着細胞における「大ピノサイト指数」を決定するための自動アッセイの概略図。バイオレンダーを使用して作成されました。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
実験とデータ収集の品質は、試薬の品質、設定の最適化、カバースリップとマイクロプレートの清浄度に大きく依存します。最終結果は、反復間の変動が最小限に抑えられるはずです。しかし、生物学的変異は自然に起こるか、そうでなければ多くの要因によって引き起こされる可能性があります。細胞密度は、細胞がマクロピノサイトーシス誘導剤または阻害剤に多かれ少なかれ応答する?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、TRDRPポスドクフェローシップ賞(T30FT0952)の受賞者であるC.C. KMO.G.へのNIH/NCI助成金(R01CA207189、R21CA243701)によって支援されました。BioTek Cytation 5は、NCI Cancer Center Support Grant(P30 CA030199)から財政的支援を受けているSanford Burnham Prebys Cell Imaging Coreの一部です。図 1 ~ 3 は、BioRender を使用して作成されました。
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

