Imágenes y análisis automatizados para la cuantificación de macropinosomas marcados fluorescentemente
Summary
Los ensayos automatizados que utilizan microplacas de múltiples pocillos son enfoques ventajosos para identificar reguladores de vías al permitir la evaluación de una multitud de condiciones en un solo experimento. Aquí, hemos adaptado el protocolo de cuantificación e imágenes de macropinosomas bien establecido a un formato de microplaca de 96 pocillos y proporcionamos un esquema completo para la automatización utilizando un lector de placas multimodo.
Abstract
La macropinocitosis es una vía de captación de fase fluida no específica que permite a las células internalizar una gran carga extracelular, como proteínas, patógenos y desechos celulares, a través de la endocitosis a granel. Esta vía juega un papel esencial en una variedad de procesos celulares, incluida la regulación de las respuestas inmunes y el metabolismo de las células cancerosas. Dada esta importancia en la función biológica, el examen de las condiciones del cultivo celular puede proporcionar información valiosa mediante la identificación de reguladores de esta vía y la optimización de las condiciones que se emplearán en el descubrimiento de nuevos enfoques terapéuticos. El estudio describe una técnica automatizada de imágenes y análisis utilizando equipos de laboratorio estándar y un lector de placas multimodo de imágenes celulares para la cuantificación rápida del índice macropinocítico en células adherentes. El método automatizado se basa en la absorción de dextrano fluorescente de alto peso molecular y se puede aplicar a microplacas de 96 pocillos para facilitar las evaluaciones de múltiples condiciones en un experimento o muestras fijas montadas en cubiertas de vidrio. Este enfoque tiene como objetivo maximizar la reproducibilidad y reducir la variación experimental, al tiempo que ahorra tiempo y es rentable.
Introduction
La vía endocítica inespecífica de la macropinocitosis permite a las células internalizar una variedad de componentes extracelulares, incluidos nutrientes, proteínas, antígenos y patógenos, a través de la absorción masiva de líquido extracelular y sus constituyentes1. Aunque es importante para la biología de numerosos tipos celulares, cada vez más, se describe que la vía de la macropinocitosis desempeña un papel esencial en la biología tumoral, donde, a través de la captación macropinocítica, las células tumorales son capaces de sobrevivir y proliferar en presencia de un microambiente agotado de nutrientes2,3. La absorción de macromoléculas extracelulares, incluyendo albúmina y matriz extracelular, y restos de células necróticas, proporciona una fuente alternativa de nutrientes para la producción de biomasa mediante la creación de aminoácidos, azúcares, lípidos y nucleótidos a través del catabolismo de carga mediado por fusión de macropinosomas y lisosomas4,5,6,7,8.
La inducción y regulación de la macropinocitosis son complejas y pueden variar dependiendo del contexto celular. Hasta el momento, se han identificado varios inductores de macropinocitosis e incluyen ligandos, como el factor de crecimiento epidérmico (EGF), el factor de crecimiento derivado de plaquetas (PDGF), la galectina-3 y Wnt3A9,10,11,12,13. Además, las condiciones de cultivo que imitan el microambiente tumoral pueden desencadenar la activación de la vía. Los tumores de adenocarcinoma ductal pancreático (PDAC) carecen de nutrientes, especialmente para el aminoácido glutamina, que hace que tanto las células cancerosas como los fibroblastos asociados al cáncer (CAF) dependan de la macropinocitosis para la supervivencia7,13,14,15. Además, el estrés tumoral, como la hipoxia y el estrés oxidativo, puede activar esta vía carroñera16. Además de los numerosos influenciadores extrínsecos que pueden inducir macropinocitosis, una variedad de vías intracelulares controlan la formación de macropinosomas. La transformación oncogénica mediada por Ras es suficiente para iniciar la maquinaria macropinocítica, y múltiples tipos de cáncer exhiben macropinocitosis constitutiva oncogénica impulsada por Ras4,5,9,17. Alternativamente, se han identificado la activación de Ras de tipo salvaje y las vías independientes de Ras para activar la macropinocitosis en células cancerosas y CAF10,11,15,18. El uso de varios modelos in vitro en combinación con tratamientos con inhibidores ha dado como resultado la identificación de varios moduladores de macropinocitosis, que incluyen intercambiadores de sodio-hidrógeno, la pequeña GTPasa Rac1, fosfoinositida 3-quinasa (PI3K), quinasa activada por p21 (Pak) y proteína quinasa activada por AMP (AMPK)4,13,15 . Sin embargo, dada la multitud de factores y condiciones descritos que regulan la macropinocitosis, es concebible que muchos más moduladores y estímulos permanezcan sin descubrir. La identificación de nuevos moduladores y estímulos puede facilitarse mediante la evaluación automatizada de una multitud de condiciones en un solo experimento. Esta metodología puede arrojar luz sobre los factores involucrados en la formación de macropinosomas y puede permitir el descubrimiento de nuevas moléculas pequeñas o productos biológicos que se dirigen a esta vía.
Aquí, hemos adaptado nuestro protocolo previamente establecido para determinar el grado de macropinocitosis en células cancerosas in vitro a un formato de microplaca de 96 pocillos e imágenes y cuantificación automatizadas19,20. Este protocolo se basa en la microscopía fluorescente, que se ha convertido en un estándar en el campo para determinar la macropinocitosis in vitro e in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Los macropinosomas se pueden distinguir de otras vías endocíticas por su capacidad para internalizar macromoléculas grandes, como el dextrano de alto peso molecular (es decir, 70 kDa)2,3,4,20,21,22,23. Por lo tanto, los macropinosomas se pueden definir a través de la absorción de dextrano de 70 kDa marcado con fluoróforo administrado extracelularmente. Como resultado, las vesículas macropinocíticas se manifiestan como grupos intracelulares de puntúas fluorescentes con tamaños que oscilan entre 0,2 y 5 μm. Estos puntos pueden ser fotografiados microscópicamente y posteriormente cuantificados para determinar el alcance de la macropinocitosis en la célula- ‘el índice macropinocítico’.
En este protocolo, se describen los pasos esenciales para visualizar macropinosomas en células adherentes in vitro en una microplaca de 96 pocillos y cubiertas utilizando equipos de laboratorio estándar (Figura 1). Además, se proporcionan las instrucciones para automatizar la adquisición de imágenes y la cuantificación del índice macropinocítico utilizando un lector de placas multimodo de imágenes celulares. Esta automatización reduce el tiempo, el costo y el esfuerzo en comparación con nuestros protocolos descritos anteriormente19,20. Además, evita la adquisición y el análisis de imágenes involuntariamente sesgados y, por lo tanto, mejora la reproducibilidad y la confiabilidad. Este método se puede adaptar fácilmente a diferentes tipos de células o lectores de placas o utilizarse para determinar características alternativas del macropinosoma, como el tamaño, el número y la ubicación. El método aquí descrito es especialmente adecuado para el cribado de condiciones de cultivo celular que inducen macropinocitosis, la identificación de nuevos moduladores o la optimización de las concentraciones de fármacos de inhibidores conocidos.
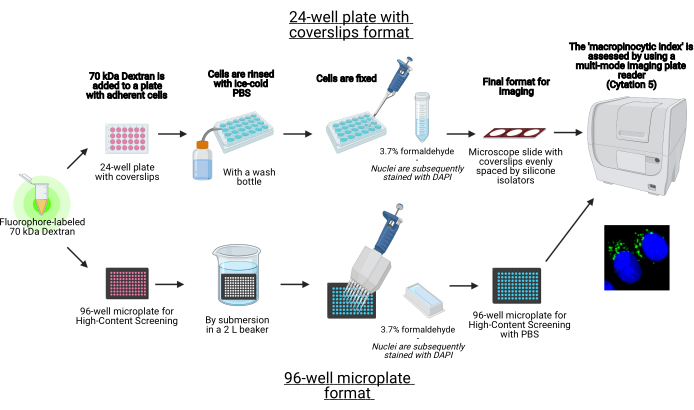
Figura 1: Esquema del ensayo automatizado para determinar el ‘índice macropinocítico’ en células adherentes. Creado usando BioRender. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La calidad de los experimentos y la adquisición de datos depende en gran medida de la calidad de los reactivos, la optimización de la configuración y la limpieza de las cubiertas y la microplaca. Los resultados finales deben dar una variación mínima entre las réplicas; sin embargo, las variaciones biológicas ocurren naturalmente o pueden ser causadas por una serie de factores. La densidad celular puede hacer que las células respondan más o menos a los inductores o inhibidores de la macropinocitosis. Por lo tanto…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por subvenciones de nih/NCI (R01CA207189, R21CA243701) a C.C. KMO.G. ha recibido un Premio de Beca Postdoctoral TRDRP (T30FT0952). La Citación BioTek 5 es parte del Sanford Burnham Prebys Cell Imaging Core, que recibe apoyo financiero de la Subvención de Apoyo al Centro Oncológico del NCI (P30 CA030199). Las figuras 1-3 se crearon utilizando BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

