Imagem e Análise Automatizada para a Quantificação de Macropinoss fluorescentes rotulados
Summary
Ensaios automatizados usando microplatas multi-poços são abordagens vantajosas para identificar reguladores de vias, permitindo a avaliação de uma infinidade de condições em um único experimento. Aqui, adaptamos o bem estabelecido protocolo de imagem e quantificação de macropinoso para um formato de microplacão de 96 poços e fornecemos um contorno abrangente para automação usando um leitor de placas de vários modos.
Abstract
Macropinocistose é uma via de absorção não específica da fase de fluidos que permite que as células internalizem grandes cargas extracelulares, como proteínas, patógenos e detritos celulares, através da endocitose a granel. Esse caminho desempenha um papel essencial em uma variedade de processos celulares, incluindo a regulação de respostas imunes e metabolismo de células cancerosas. Dada essa importância na função biológica, examinar as condições da cultura celular pode fornecer informações valiosas identificando reguladores dessa via e otimizando condições a serem empregadas na descoberta de novas abordagens terapêuticas. O estudo descreve uma técnica automatizada de imagem e análise utilizando equipamentos de laboratório padrão e um leitor de placas multimodestração de imagem celular para a rápida quantificação do índice macropinocítico em células aderentes. O método automatizado baseia-se na absorção de dextran fluorescente de alto peso molecular e pode ser aplicado a microplacões de 96 poços para facilitar avaliações de múltiplas condições em um experimento ou amostras fixas montadas em tampas de vidro. Esta abordagem visa maximizar a reprodutibilidade e reduzir a variação experimental, ao mesmo tempo em que economiza tempo e econômica.
Introduction
A via endocítica não específica da macropinocistose permite que as células internalizem uma variedade de componentes extracelulares, incluindo nutrientes, proteínas, antígenos e patógenos, através da absorção em massa de fluido extracelular e seus constituintes1. Embora importante para a biologia de numerosos tipos celulares, cada vez mais, a via macropinotose é descrita como um papel essencial na biologia tumoral, onde, através da absorção macropinócítica, as células tumorais são capazes de sobreviver e proliferar na presença de um microambiente empobrecido de nutrientes2,3. A absorção de macromoléculas extracelulares, incluindo albumina e matriz extracelular, e detritos de células necróticas, fornece uma fonte alternativa de nutrientes para a produção de biomassa, criando aminoácidos, açúcares, lipídios e nucleotídeos através de macropinoso e catabolismo de carga mediado por fusão4,5,6,7,8.
A indução e regulação da macropinocitose são complexas e podem variar dependendo do contexto celular. Até agora, vários indutores de macropinocistose foram identificados e incluem ligantes, como fator de crescimento epidérmico (EGF), fator de crescimento derivado de plaquetas (PDGF), galectina-3 e Wnt3A9,10,11,12,13. Além disso, condições de cultivo que imitam o microambiente tumoral podem desencadear a ativação da via. Os tumores de adenocarcinoma ductal pancreático (PDAC) são privados de nutrientes, especialmente para a glutamina aminoácido, que faz com que tanto as células cancerígenas quanto os fibroblastos associados ao câncer (CAFs) dependam da macropinocise para sobreviver7,13,14,15. Além disso, as tensões tumorais, como a hipóxia e o estresse oxidativo, podem ativar essa via de limpeza16. Além dos inúmeros influenciadores extrínsecos que podem induzir a macropinocisse, uma variedade de vias intracelulares controlam a formação macropinosa. A transformação oncogênica mediada por Ras é suficiente para iniciar o maquinário macropinocítico, e vários tipos de câncer exibem macropinocistose constitutiva oncogênica baseada em Ras4,5,9,17. Alternativamente, a ativação ras do tipo selvagem e vias independentes de Ras foram identificadas para ativar a macropinocistose em células cancerosas e CAFs10,11,15,18. O uso de vários modelos in vitro em combinação com tratamentos inibidores resultou na identificação de vários moduladores de macropinocise, que incluem trocadores de sódio-hidrogênio, o pequeno GTPase Rac1, fosfoinositida 3-quinase (PI3K), quinase ativada p21 (Pak) e proteína ativada amp(AMPK)4,13,15 . No entanto, dada a multiplicidade de fatores e condições descritos que regulam a macropinocistose, é concebível que muitos mais moduladores e estímulos permaneçam desconhecidos. A identificação de novos moduladores e estímulos pode ser facilitada pela avaliação automatizada de uma infinidade de condições em um único experimento. Essa metodologia pode lançar luz sobre os fatores envolvidos na formação de macropinossomos e pode permitir a descoberta de novas pequenas moléculas ou biológicas que visam esse caminho.
Aqui, adaptamos nosso protocolo previamente estabelecido para determinar a extensão da macropinocistose em células cancerosas in vitro para um formato de microplacão de 96 poços e imagem automatizada e quantificação19,20. Este protocolo é baseado na microscopia fluorescente, que se tornou um padrão no campo para determinar a macropinocise in vitro e in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Macropinossomos podem ser distinguidos de outras vias endocíticas através de sua capacidade de internalizar grandes macromoléculas, como dextran de alto peso molecular (ou seja, 70 kDa)2,3,4,20,21,22,23. Assim, macropinossomos podem ser definidos através da absorção de fluorforotos extracelularmente rotulados de 70 kDa dextran. Como resultado, as vesículas macropinocísticas se manifestam como aglomerados intracelulares de puncta fluorescente com tamanhos que variam de 0,2-5 μm. Esses punctas podem ser imagens microscopicamente e, posteriormente, quantificadas para determinar a extensão da macropinocise na célula – “o índice macropinocítico”.
Neste protocolo, são descritas as etapas essenciais para visualizar macropinossomos em células aderentes in vitro em uma microplacão de 96 poços e são descritas manchas usando equipamentos de laboratório padrão (Figura 1).” Além disso, são fornecidas as instruções para automatizar a aquisição e quantificação da imagem do índice macropinocítico usando um leitor de placas multimodesas de imagem celular. Essa automação reduz o tempo, o custo e o esforço em comparação com nossos protocolos descritos anteriormente19,20. Além disso, evita a aquisição e análise de imagens sem querer tendenciosas e, assim, aumenta a reprodutibilidade e a confiabilidade. Este método pode ser facilmente adaptado a diferentes tipos de células ou leitores de placas ou ser utilizado para determinar características macropinosas alternativas, como tamanho, número e localização. O método aqui descrito é especialmente adequado para a triagem de condições de cultura celular que induzem a macropinocistose, a identificação de novos moduladores ou a otimização de concentrações de medicamentos de inibidores conhecidos.
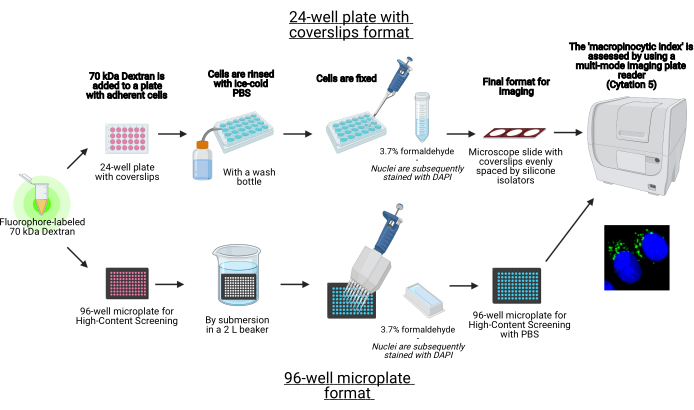
Figura 1: Esquema do ensaio automatizado para determinar o “índice macropinolítico” em células aderentes. Criado usando BioRender. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A qualidade dos experimentos e a aquisição de dados dependem muito da qualidade dos reagentes, da otimização das configurações e da limpeza das tampas e das microplacões. Os resultados finais devem dar uma variação mínima entre as réplicas; no entanto, as variações biológicas ocorrem naturalmente ou podem ser causadas por uma série de fatores. A densidade celular pode fazer com que as células respondam mais ou menos aos indutores ou inibidores da macropinocitose. É, portanto, crucial aderir à confluênc…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado por subvenções do NIH/NCI (R01CA207189, R21CA243701) a C.C. KMO.G. é um beneficiário do TRDRP Postdoctoral Fellowship Award (T30FT0952). O BioTek Cytation 5 é uma parte do Núcleo de Imagens de Células Prebys de Sanford Burnham, que recebe apoio financeiro do NCI Cancer Center Support Grant (P30 CA030199). As figuras 1-3 foram criadas utilizando-se o BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

