형광 표기 매크로피노좀의 정량화를 위한 자동화된 이미징 및 분석
Summary
멀티웰 마이크로플레이트를 사용하는 자동화된 해석은 단일 실험에서 다양한 조건의 평가를 허용함으로써 경로 조절기관을 식별하는 데 유리한 접근 방식입니다. 여기에서는 잘 확립된 매크로피노솜 이미징 및 정량화 프로토콜을 96웰 마이크로플레이트 형식으로 조정했으며 멀티 모드 플레이트 판독기를 사용하여 자동화를 위한 포괄적인 개요를 제공합니다.
Abstract
Macropinocytosis는 세포가 대량 내세포증을 통해 단백질, 병원균 및 세포 파편과 같은 큰 세포외 화물을 내면화할 수 있는 비특이적 유체 상 섭취 경로입니다. 이 통로는 면역 반응과 암 세포 대사의 조절을 포함하여 다양한 세포 프로세스에서 필수적인 역할을 합니다. 생물학적 기능에 있는 이 중요성을 감안할 때, 세포 배양 조건을 검토하는 것은 이 통로의 레귤레이터를 확인하고 새로운 치료 접근의 발견에 이용될 조건을 최적화해서 귀중한 정보를 제공할 수 있습니다. 이 연구는 부착 된 세포에서 매크로 피노키틱 인덱스의 신속한 정량화를 위한 표준 실험실 장비 및 세포 이미징 다중 모드 플레이트 리더를 사용하여 자동화 된 이미징 및 분석 기술을 설명합니다. 자동화된 방법은 고분자 형광 dextran의 섭취를 기반으로 하며 유리 커버립에 장착된 하나의 실험 또는 고정 샘플에서 여러 조건의 평가를 용이하게 하기 위해 96웰 마이크로플레이트에 적용할 수 있다. 이 방법은 재현성을 극대화하고 실험적 변화를 줄이는 동시에 시간 절약과 비용 효율적인 방식을 목표로 합니다.
Introduction
macropinocytosis의 비 특이적 내세포 통로는 세포세포 액체와 그 성분의 대량 섭취를 통해 영양분, 단백질, 항원 및 병원균을 포함한 다양한 세포 외 구성 요소를 내면화 할 수 있습니다1. 수많은 세포 모형의 생물학을 위해 중요하더라도, 점점, macropinocytosis 통로는 종양 생물학에 있는 필수적인 역할을 하기 위하여 기술됩니다, 여기서, 대식세포 섭취를 통해, 종양 세포는 영양 고갈된 microenvironment2의 존재에서 생존하고 증식할 수 있습니다2,3. 알부민 및 세포 외 매트릭스및 괴사 세포 파편을 포함한 세포 외 거대 분자의 섭취는 거형 및 리소솜 및 리소성 융합 매개화물 이화 이화증4,5,6,7,8을 통해 아미노산, 설탕, 지질 및 뉴클레오티드를 생성하여 바이오매스 생산을위한 대체 영양소 소스를 제공합니다.
거시피노세포증의 유도 및 조절은 복잡하고 세포 상황에 따라 달라질 수 있습니다. 지금까지, 거형피노세포증의 몇몇 유도체가 확인되고 표피 성장인자(EGF), 혈소판 유래 성장인자(PDGF), galectin-3 및 Wnt3A9,10,11,12,13과 같은 리간드를 포함하고 있다. 또한, 종양 미세 환경을 모방하는 배양 조건은 통로의 활성화를 시작할 수 있다. 췌장 덕트 아데노암종 (PDAC) 종양은 특히 암세포와 암 관련 섬유아세포 (CAFs)를 모두 생존을 위한 매크로 피노세포증에 의존하는 아미노산 글루타민을 위해 영양 박탈입니다7,13,14,15. 더욱이, 저산소증 및 산화 스트레스와 같은 종양 응력은, 이 청소 통로를 활성화할 수 있습니다16. 거시화증을 유도할 수 있는 수많은 외외성 인플루언서 외에도, 다양한 세포내 통로가 거시성 형성을 제어한다. 종양 유발 Ras 매개 변환은 대식세포 기계를 시작하기에 충분하며, 다중 암 유형은 종양genic Ras 구동 구성 매크로 피노세포4,5,9,17를 나타낸다. 대안적으로, 야생형 Ras 활성화 및 Ras 독립적인 통로는 암세포및 CAFs10,11,15,18에서 macropinocytosis를 활성화하기 위하여 확인되었습니다. 억제제 처리와 결합하여 다양한 체외 모델을 사용하면 나트륨 수소 교환기, 소형 GTPase Rac1, 인포이티드 3키나제(PI3K), p21 활성화 키나아제(Pak), AMP 활성화 단백질 키나제(AMPK,15,15)를 포함하는 여러 매크로피노시토시스 변조기를 식별하게 되었습니다. . 그러나, 거시적인 세포토증을 조절하는 기술된 요인 및 조건의 무리를 감안할 때, 더 많은 변조기와 자극이 발견되지 않은 채로 남아 있다는 것을 생각할 수 있습니다. 새로운 변조기와 자극의 식별은 단일 실험에서 다양한 조건의 자동화된 평가에 의해 촉진될 수 있다. 이 방법론은 거형 형성에 관련되되거나 이 통로를 표적으로 하는 새로운 작은 분자 또는 생물학의 발견을 허용할 수 있습니다.
여기에서, 우리는 96 웰 마이크로 플레이트 형식 및 자동화된 화상 진찰 및 정량화19,20에 시험관 내암세포증의 정도를 결정하기 위한 우리의 이전에 확립된 프로토콜을 조정했습니다. 본 프로토콜은 형광 현미경 검사법을 기반으로 하며, 이는 시험관 내 및 생체 내에서 거피노세포증을 결정하는 분야에서 표준이 되었으며, 생체 내에서 4,5,6,7,9,9,10,12,12,15,15,17,18, 19,20,21,22. 매크로피노솜은 고분자 량 dextran(즉, 70 kDa)2,3,4,20,21,22,23과 같은 대형 거대 분자를 내면화하는 능력을 통해 다른 내세포 경로와 구별될 수 있다. 따라서, 거시피노솜은 세포외 투여형 형광소-표지70 kDa dextran의 섭취를 통해 정의될 수 있다. 그 결과, 매크로피노시성 소포는 0.2-5 μm에 이르는 크기의 형광 문크타의 세포내 클러스터로 나타납니다. 이러한 말장난은 세포내의 대식세포증의 정도를 결정하기 위해 현미경으로 이미지화되고 이후에 정량화될 수 있다- ‘대식세포 지수’.
이 프로토콜에서, 표준 실험실 장비를 사용하여 96웰 마이크로 플레이트 및 커버립에 체외에서 부착 된 세포에서 대식체를 시각화하는 필수적인 단계가 설명된다 (그림 1). 또한, 셀 이미징 다중 모드 플레이트 판독기를 이용하여 매크로피노사이클 지수의 이미지 수집 및 정량화를 자동화하는 방향이 제공된다. 이 자동화는 이전에 설명한 프로토콜19,20에 비해 시간, 비용 및 노력을 줄여줍니다. 또한 의도하지 않게 편향된 이미징 수집 및 분석을 방지하여 재현성과 신뢰성을 향상시킵니다. 이 방법은 다른 세포 유형 또는 플레이트 판독기에 쉽게 적응하거나 크기, 숫자 및 위치와 같은 대체 매크로 피노솜 특징을 결정하는 데 활용할 수 있습니다. 본 명세서에 기재된 방법은 거시피노세포증을 유도하는 세포 배양 조건의 선별, 새로운 변조기의 식별 또는 알려진 억제제의 약물 농도의 최적화에 특히 적합하다.
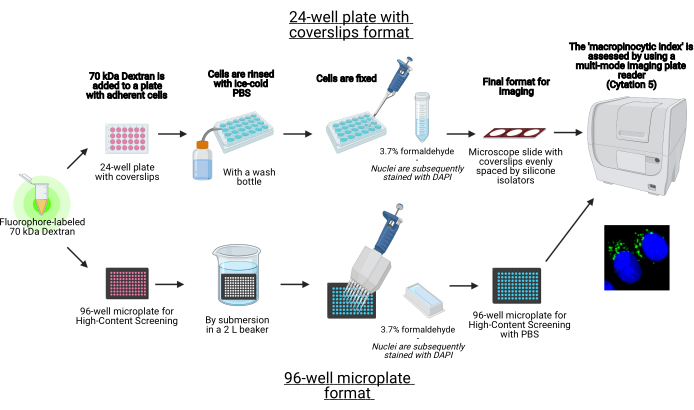
그림 1: 고동체 세포의 ‘대식세포 지수’를 결정하는 자동화된 분석의 회로도. BioRender를 사용하여 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
실험 및 데이터 수집의 품질은 시약의 품질, 설정 최적화 및 커버립 및 마이크로 플레이트의 청결에 따라 크게 달라집니다. 최종 결과는 복제 간에 최소한의 변형을 제공해야 합니다. 그러나 생물학적 변이는 자연적으로 발생하거나 여러 가지 요인에 의해 발생할 수 있습니다. 세포 밀도는 세포가 거시세포증 유도제 또는 억제제에 다소 반응하도록 원인이 될 수 있다. 따라서 프로토콜에서 제안된…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작품은 NIH/NCI 보조금(R01CA207189, R21CA243701)이 C.C KMO.G.에 지원하여 TRDRP 박사 후 펠로우십 어워드(T30FT0952)의 수상자입니다. BioTek Cytation 5는 NCI 암 센터 지원 보조금 (P30 CA030199)으로부터 재정 지원을받는 샌포드 번햄 프리비스 세포 이미징 코어의 일부입니다. 그림 1-3은 BioRender를 사용하여 만들어졌습니다.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

