Automatisert avbildning og analyse for kvantifisering av fluorescerende merkede makropinosomer
Summary
Automatiserte analyser ved bruk av mikroplater med flere brønner er fordelaktige tilnærminger for å identifisere veiregulatorer ved å tillate vurdering av en rekke forhold i et enkelt eksperiment. Her har vi tilpasset den veletablerte makropinosomavbildnings- og kvantifiseringsprotokollen til et 96-brønns mikroplateformat og gir en omfattende disposisjon for automatisering ved hjelp av en flermodusplateleser.
Abstract
Makropinocytose er en ikke-spesifikk væskefaseopptaksvei som gjør det mulig for celler å internalisere stor ekstracellulær last, som proteiner, patogener og celleavfall, gjennom bulk endokytose. Denne banen spiller en viktig rolle i en rekke cellulære prosesser, inkludert regulering av immunresponser og kreftcellemetabolisme. Gitt denne betydningen i biologisk funksjon, kan undersøkelse av cellekulturforhold gi verdifull informasjon ved å identifisere regulatorer for denne veien og optimalisere forholdene som skal brukes i oppdagelsen av nye terapeutiske tilnærminger. Studien beskriver en automatisert bilde- og analyseteknikk ved hjelp av standard laboratorieutstyr og en multimodusplateleser for celleavbildning for rask kvantifisering av makropinocytisk indeks i tilhengerceller. Den automatiserte metoden er basert på opptak av fluorescerende dekstran med høy molekylvekt og kan brukes på 96-brønns mikroplater for å lette vurderinger av flere forhold i ett eksperiment eller faste prøver montert på glassdeksler. Denne tilnærmingen tar sikte på å maksimere reproduserbarhet og redusere eksperimentell variasjon samtidig som den er både tidsbesparende og kostnadseffektiv.
Introduction
Den ikke-spesifikke endokytiske banen til makropinocytose gjør det mulig for celler å internalisere en rekke ekstracellulære komponenter, inkludert næringsstoffer, proteiner, antigener og patogener, gjennom bulkopptak av ekstracellulær væske og dens bestanddeler1. Selv om det er viktig for biologien til mange celletyper, er makropinocytosebanen i økende grad beskrevet for å spille en viktig rolle i tumorbiologien, hvor tumorceller gjennom makropinocytisk opptak er i stand til å overleve og spre seg i nærvær av et næringsfattig mikromiljø2,3. Opptaket av ekstracellulære makromolekyler, inkludert albumin og ekstracellulær matrise, og nekrotisk celleavfall, gir en alternativ næringskilde for biomasseproduksjon ved å lage aminosyrer, sukker, lipider og nukleotider gjennom makropinosom og lysosomet fusjonsmediert lastkaboisme4,5,6,7,8.
Induksjonen og reguleringen av makropinocytose er kompleks og kan variere avhengig av cellulær kontekst. Så langt har flere indusere av makropinocytose blitt identifisert og inkluderer ligander, for eksempel epidermal vekstfaktor (EGF), blodplate-avledet vekstfaktor (PDGF), galectin-3 og Wnt3A9,10,11,12,13. I tillegg kan dyrkingsforhold som etterligner tumormikromiljøet utløse aktivering av banen. Bukspyttkjertelkanal adenokarsinom (PDAC) svulster er næringsfattige, spesielt for aminosyre glutamin, noe som fører til at både kreftceller og kreftrelaterte fibroblaster (CAFs) er avhengige av makropinocytose for overlevelse7,13,14,15. Videre kan tumorspenninger, som hypoksi og oksidativt stress, aktivere denne scavenging pathway16. I tillegg til de mange ekstrinsiske påvirkerne som kan indusere makropinocytose, kontrollerer en rekke intracellulære veier makropinosomdannelse. Onkogen Ras-mediert transformasjon er tilstrekkelig til å initiere det makropinocytiske maskineriet, og flere krefttyper utviser onkogen Ras-drevet konstituerende makropinocytose4,5,9,17. Alternativt er villtype Ras-aktivering og Ras-uavhengige veier identifisert for å aktivere makropinocytose i kreftceller og CAFs10,11,15,18. Bruken av ulike in vitro-modeller i kombinasjon med inhibitorbehandlinger har resultert i identifisering av flere makropinocytosemodulatorer, som inkluderer natrium-hydrogenvekslere, den lille GTPase Rac1, fosfoinositid 3-kinase (PI3K), p21-aktivert kinase (Pak) og AMP-aktivert proteinkinase (AMPK) 4,13,15 . Men gitt mangfoldet av beskrevne faktorer og forhold som regulerer makropinocytose, er det tenkelig at mange flere modulatorer og stimuli forblir uoppdaget. Identifisering av nye modulatorer og stimuli kan lettes ved automatisert vurdering av en rekke forhold i et enkelt eksperiment. Denne metoden kan belyse faktorene som er involvert i makropinosomdannelse og kan tillate oppdagelsen av nye små molekyler eller biologer som retter seg mot denne veien.
Her har vi tilpasset vår tidligere etablerte protokoll for å bestemme omfanget av makropinocytose i kreftceller in vitro til et 96-brønns mikroplateformat og automatisert avbildning og kvantifisering19,20. Denne protokollen er basert på fluorescerende mikroskopi, som har blitt en standard i feltet for å bestemme makropinocytose in vitro og in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Makropinosomer kan skille seg fra andre endokytiske veier gjennom deres evne til å internalisere store makromolekyler, som høymolekylær dextran (dvs. 70 kDa)2,3,4,20,21,22,23. Dermed kan makropinosomer defineres gjennom opptak av ekstracellulært administrert fluorofor-merket 70 kDa dextran. Som et resultat manifesterer makropinocytiske vesikler som intracellulære klynger av fluorescerende puncta med størrelser fra 0,2-5 μm. Disse puncta kan mikroskopisk avbildes og deretter kvantifiseres for å bestemme omfanget av makropinocytose i cellen – ‘den makropinocytiske indeksen’.
I denne protokollen er de viktigste trinnene for å visualisere makropinosomer i adherentceller in vitro på en 96-brønns mikroplate og deksler ved hjelp av standard laboratorieutstyr beskrevet (figur 1). I tillegg er instruksjonene for å automatisere bildeanskaffelsen og kvantifiseringen av den makropinocytiske indeksen ved hjelp av en celleavbildningsplateleser i flere moduser gitt. Denne automatiseringen reduserer tid, kostnader og krefter sammenlignet med våre tidligere beskrevne protokoller19,20. I tillegg unngår den utilsiktet partisk bildeinnsamling og analyse og forbedrer dermed reproduserbarhet og pålitelighet. Denne metoden kan enkelt tilpasses ulike celletyper eller platelesere eller brukes til å bestemme alternative makropinosomfunksjoner, for eksempel størrelse, antall og plassering. Den heri beskrevne metoden er spesielt egnet for screening av cellekulturforhold som induserer makropinocytose, identifisering av nye modulatorer eller optimalisering av legemiddelkonsentrasjoner av kjente inhibitorer.
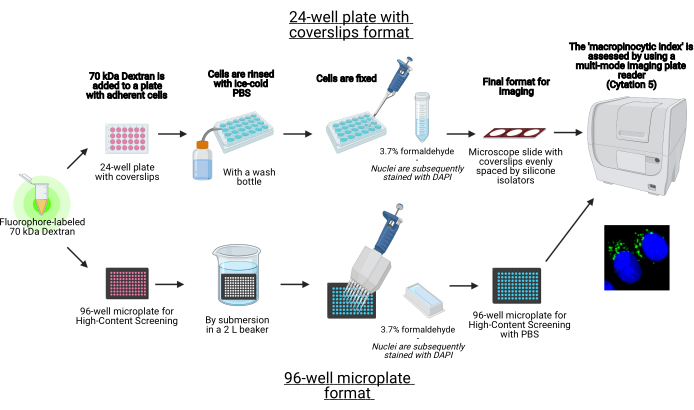
Figur 1: Skjematisk for den automatiserte analysen for å bestemme den ‘makropinocytiske indeksen’ i tilhengerceller. Opprettet ved hjelp av BioRender. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Kvaliteten på forsøkene og datainnsamlingen avhenger sterkt av kvaliteten på reagensene, optimaliseringen av innstillingene og rensligheten av dekslene og mikroplaten. De endelige resultatene skal gi minimal variasjon mellom replikeringer; Biologiske variasjoner forekommer imidlertid naturlig eller kan på annen måte være forårsaket av en rekke faktorer. Celletetthet kan føre til at celler reagerer mer eller mindre på makropinocytoseindusere eller hemmere. Det er derfor avgjørende å følge 80% samløp som fores…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av NIH/NCI grants (R01CA207189, R21CA243701) til C.C. KMO.G. er mottaker av en TRDRP Postdoctoral Fellowship Award (T30FT0952). BioTek Cytation 5 er en del av Sanford Burnham Prebys Cell Imaging Core, som mottar økonomisk støtte fra NCI Cancer Center Support Grant (P30 CA030199). Figur 1-3 ble opprettet ved hjelp av BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

