Automatiserad avbildning och analys för kvantifiering av fluorescerande märkta makropinosomer
Summary
Automatiserade analyser med hjälp av mikroplattor med flera brunnar är fördelaktiga metoder för att identifiera vägregulatorer genom att möjliggöra bedömning av en mängd villkor i ett enda experiment. Här har vi anpassat det väletablerade makropinosombilds- och kvantifieringsprotokollet till ett 96-väl mikroplattaformat och ger en omfattande disposition för automatisering med hjälp av en flerlägesplattaläsare.
Abstract
Makropinocytos är en icke-specifik vätskefas upploppsväg som gör det möjligt för celler att internalisera stor extracellulär last, såsom proteiner, patogener och cellskräp, genom bulk endocytos. Denna väg spelar en viktig roll i en mängd cellulära processer, inklusive reglering av immunsvar och cancercellsmetabolism. Med tanke på denna betydelse i biologisk funktion kan undersökning av cellodlingsförhållanden ge värdefull information genom att identifiera tillsynsmyndigheter för denna väg och optimera villkor som ska användas vid upptäckten av nya terapeutiska metoder. Studien beskriver en automatiserad bild- och analysteknik med hjälp av standard laboratorieutrustning och en cellavbildningsplatta för snabb kvantifiering av makropinocytiskt index i vidhäftande celler. Den automatiserade metoden är baserad på upptag av fluorescerande dextran med hög molekylvikt och kan appliceras på 96-brunnsmikroplattor för att underlätta bedömningar av flera förhållanden i ett experiment eller fasta prover monterade på glasöverdrag. Detta tillvägagångssätt syftar till att maximera reproducerbarheten och minska experimentell variation samtidigt som den är både tidsbesparande och kostnadseffektiv.
Introduction
Den icke-specifika endocytiska vägen för makropinocytos gör det möjligt för celler att internalisera en mängd extracellulära komponenter, inklusive näringsämnen, proteiner, antigener och patogener, genom bulkupptag av extracellulär vätska och dess beståndsdelar1. Även om det är viktigt för biologin hos många celltyper, beskrivs makropinocytosvägen i allt högre grad spela en viktig roll i tumörbiologi, där tumörceller genom makropinocytisk upptaktning kan överleva och föröka sig i närvaro av en näringsfattig mikromiljö2,3. Upptaget av extracellulära makromolekyler, inklusive albumin och extracellulär matris, och nekrotiska cellrester, ger en alternativ näringskälla för biomassaproduktion genom att skapa aminosyror, sockerarter, lipider och nukleotider genom makropinosom och lysosom fusionsmedierad lastkatabolism4,5,6,7,8.
Induktion och reglering av makropinocytos är komplexa och kan variera beroende på cellulära sammanhang. Hittills har flera inducerare av makropinocytos identifierats och inkluderar ligands, såsom epidermal tillväxtfaktor (EGF), trombocyt-härledda tillväxtfaktor (PDGF), galectin-3 och Wnt3A9,10,11,12,13. Dessutom kan odlingsförhållanden som efterliknar tumörmikromiljön utlösa aktivering av vägen. Bukspottskörteln duktal adenocarcinom (PDAC) tumörer är näringsfattiga, särskilt för aminosyran glutamin, vilket gör att både cancerceller och cancerassocierade fibroblaster (CAFs) förlitar sig på makropinocytos för överlevnad7,13,14,15. Dessutom kan tumörspänningar, såsom hypoxi och oxidativ stress, aktivera denna rensningsväg16. Förutom de många extrinsic påverkare som kan inducera macropinocytosis, en mängd intracellulära vägar kontrollera makropinosom bildas. Onkogen Rasmedierad transformation är tillräcklig för att initiera makropinocytiska maskineri, och flera cancertyper uppvisar onkogen Ras-driven konstituerande makropinocytos4,5,9,17. Alternativt har rasaktivering av vildtyp och Ras-oberoende vägar identifierats för att aktivera makropinocytos i cancerceller och CAFs10,11,15,18. Användningen av olika in vitro-modeller i kombination med inhibitorbehandlingar har resulterat i identifiering av flera makropinocytosmodulatorer, som inkluderar natrium-väteväxlare, den lilla GTPase Rac1, fosphoinositide 3-kinas (PI3K), p21-aktiverad kinas (Pak) och AMP-aktiverad proteinkinas (AMPK)4,13,15 . Med tanke på den mängd beskrivna faktorer och villkor som reglerar makropinocytos är det dock tänkbart att många fler modulatorer och stimuli förblir oupptäckta. Identifieringen av nya modulatorer och stimuli kan underlättas genom automatiserad bedömning av en mängd villkor i ett enda experiment. Denna metodik kan kasta ljus över de faktorer som är involverade i makropinosombildning och kan möjliggöra upptäckten av nya små molekyler eller biologiska läkemedel som riktar sig till denna väg.
Här har vi anpassat vårt tidigare etablerade protokoll för att bestämma omfattningen av makropinocytos i cancerceller in vitro till ett 96-brunns mikroplate format och automatiserad avbildning och kvantifiering19,20. Detta protokoll är baserat på fluorescerande mikroskopi, som har blivit en standard inom området för att bestämma makropinocytos in vitro och in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Makropinosomer kan särskiljas från andra endocytiska vägar genom sin förmåga att internalisera stora makromolekyler, såsom hög molekylvikt dextran (dvs. 70 kDa)2,3,4,20,21,22,23. Makropinosomer kan således definieras genom upptaget av extracellulärt administrerade fluorofor-märkta 70 kDa dextran. Som ett resultat manifesterar makropinocytiska blåsor som intracellulära kluster av fluorescerande punkter med storlekar från 0,2-5 μm. Dessa punkter kan avbildas mikroskopiskt och därefter kvantifieras för att bestämma omfattningen av makropinocytos i cellen – “det makropinocytiska indexet”.
I detta protokoll beskrivs de viktigaste stegen för att visualisera makropinosomer i vidhäftande celler in vitro på en 96-väl mikroplatta och täckslipar med hjälp av standard laboratorieutrustning (figur 1). Dessutom tillhandahålls anvisningarna för att automatisera bildförvärvet och kvantifieringen av makropinocytiskt index med hjälp av en cellavbildningsplatta med flera lägen. Denna automatisering minskar tid, kostnad och ansträngning jämfört med våra tidigare beskrivna protokoll19,20. Dessutom undviker det oavsiktligt partisk bildförvärv och analys och förbättrar därmed reproducerbarhet och tillförlitlighet. Den här metoden kan enkelt anpassas till olika celltyper eller plattläsare eller användas för att bestämma alternativa makropinosomfunktioner, till exempel storlek, antal och plats. Den här beskrivs metoden är särskilt lämplig för screening av cellodling villkor som inducerar makropinocytos, identifiering av nya modulatorer eller optimering av läkemedelskoncentrationer av kända hämmare.
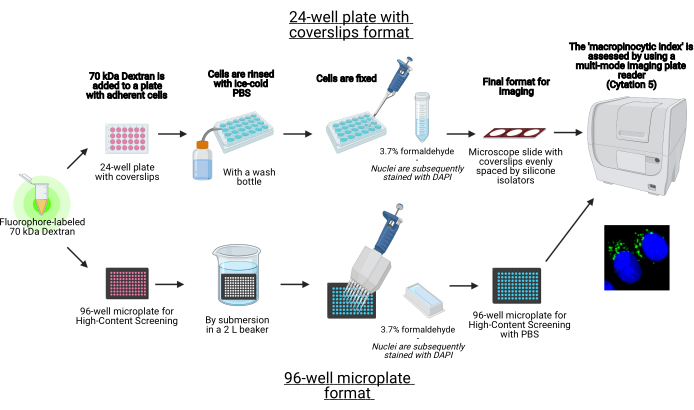
Figur 1: Schematisk av den automatiserade analysen för att bestämma det “makropinocytiska indexet” i vidhäftande celler. Skapad med BioRender. Klicka här för att se en större version av den här figuren.
Protocol
Representative Results
Discussion
Kvaliteten på experimenten och datainsamlingen beror i hög grad på reagensernas kvalitet, optimeringen av inställningarna och renheten hos täcksliparna och mikroplattan. De slutliga resultaten bör ge minimal variation mellan replikat. Biologiska variationer förekommer dock naturligt eller kan på annat sätt orsakas av ett antal faktorer. Celldensitet kan orsaka att celler reagerar mer eller mindre på makropinocytosinducerare eller hämmare. Det är därför mycket viktigt att hålla fast vid det 80-procentiga sa…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av NIH/NCI-bidrag (R01CA207189, R21CA243701) till C.C. KMO.G. är mottagare av en TRDRP Postdoctoral Fellowship Award (T30FT0952). BioTek Cytation 5 är en del av Sanford Burnham Prebys Cell Imaging Core, som får ekonomiskt stöd från NCI Cancer Center Support Grant (P30 CA030199). Figurerna 1-3 skapades med BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Cancer Research. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

