توليد الجينات والضربة القاضية في أنواع Strongyloides عن طريق الحقن المجهري
Summary
تتضمن مجموعة الأدوات الجينومية الوظيفية للديدان الخيطية الطفيلية Strongyloides stercoralis و Strongyloides ratti التحول ، والطفرات بوساطة CRISPR / Cas9 ، و RNAi. سيوضح هذا البروتوكول كيفية استخدام الحقن المجهري داخل الغدد التناسلية لإدخال الجينات المحورة ومكونات كريسبر في S. stercoralis و S. ratti.
Abstract
يتكون جنس Strongyloides من أنواع متعددة من الديدان الخيطية المخترقة للجلد مع نطاقات مضيفة مختلفة ، بما في ذلك Strongyloides stercoralis و Strongyloides ratti. S. stercoralis هو نيماتودا بشرية طفيلية تخترق الجلد تصيب ما يقرب من 610 ملايين شخص ، في حين أن طفيلي الفئران S. ratti يرتبط ارتباطا وثيقا ب S. stercoralis وغالبا ما يستخدم كنموذج مختبري ل S. stercoralis. كل من S. stercoralis و S. ratti قابلان بسهولة لتوليد الديدان المحورة والتناسلية والضربة القاضية من خلال تقنية توصيل الحمض النووي الخارجي للحقن المجهري داخل الغدد التناسلية ، وعلى هذا النحو ، ظهرت كأنظمة نموذجية للديدان الطفيلية الأخرى التي لم تكن قابلة بعد لهذه التقنية.
يعيش البالغون الطفيليون Strongyloides في الأمعاء الدقيقة لمضيفهم ويطلقون ذرية في البيئة عبر البراز. بمجرد وصولها إلى البيئة ، تتطور اليرقات إلى بالغين يعيشون بحرية ، ويعيشون في البراز وينتجون ذرية يجب أن تجد وتغزو مضيف جديد. هذا الجيل البيئي فريد من نوعه لأنواع Strongyloides ومشابه بما فيه الكفاية في مورفولوجيا لنموذج الديدان الخيطية الحية الحرة Caenorhabditis elegans بحيث يمكن تكييف التقنيات التي تم تطويرها ل C. elegans للاستخدام مع هذه الديدان الخيطية الطفيلية ، بما في ذلك الحقن المجهري داخل الغدد التناسلية. باستخدام الحقن المجهري داخل الغدد التناسلية ، يمكن إدخال مجموعة واسعة من الجينات المحورة في Strongyloides. يمكن أيضا حقن مكونات كريسبر / كاس9 الدقيقة لإنشاء يرقات Strongyloides المتحولة. هنا ، يتم وصف تقنية الحقن المجهري داخل الغدد التناسلية في Strongyloides ، بما في ذلك إعداد البالغين الذين يعيشون بحرية ، وإجراء الحقن ، واختيار النسل المعدل وراثيا. يتم تضمين صور يرقات Strongyloides المعدلة وراثيا التي تم إنشاؤها باستخدام طفرات CRISPR / Cas9. الهدف من هذه الورقة هو تمكين الباحثين الآخرين من استخدام الحقن المجهري لإنشاء Strongyloides المعدلة وراثيا والمتحولة.
Introduction
منذ فترة طويلة تم التغاضي عن Strongyloides stercoralis كممرض بشري مهم مقارنة بالديدان الخطافية المعترف بها على نطاق واسع والدودة المستديرة Ascaris lumbricoides1. غالبا ما قللت الدراسات السابقة لعبء الدودة بشدة من انتشار S. stercoralis بسبب الحساسية المنخفضة لطرق التشخيص الشائعة ل S. stercoralis2. في السنوات الأخيرة ، قدرت الدراسات الوبائية القائمة على أدوات التشخيص المحسنة أن الانتشار الحقيقي لعدوى S. stercoralis أعلى بكثير مما تم الإبلاغ عنه سابقا ، أي ما يقرب من 610 ملايين شخص في جميع أنحاء العالم2.
كل من S. stercoralis وأنواع Strongyloides الأخرى ، بما في ذلك طفيلي الفئران المرتبط ارتباطا وثيقا ونموذج المختبر المشترك S. ratti ، لديهم دورة حياة غير عادية مفيدة للدراسات الجينومية التجريبية لأنها تتكون من أجيال طفيلية وحرة (بيئية)3 (الشكل 1). على وجه التحديد ، يمكن لكل من S. stercoralis و S. ratti التنقل عبر جيل واحد من العيش الحر. يتكون جيل العيش الحر من يرقات ما بعد الطفيلية التي تتطور إلى ذكور وإناث بالغين يعيشون بحرية. تتطور جميع ذرية البالغين الذين يعيشون بحرية إلى يرقات معدية ، والتي يجب أن تصيب المضيف لمواصلة دورة الحياة. علاوة على ذلك ، يمكن التلاعب بهذا الجيل البيئي أو الحي الحر تجريبيا في المختبر. نظرا لأن البالغين الذين يعيشون بحرية في Strongyloides و C. elegans البالغين يشتركون في مورفولوجيا مماثلة ، يمكن تكييف تقنيات مثل الحقن المجهري داخل الغدد التناسلية التي تم تطويرها في الأصل ل C. elegans للاستخدام مع Strongyloides 4,5 البالغين الذين يعيشون بحرية. في حين يتم إدخال الحمض النووي بشكل عام في الإناث البالغات اللواتي يعشن بحرية ، يمكن حقن كل من الذكور والإناث من Strongyloides 6. وبالتالي ، تتوفر أدوات الجينوم الوظيفية لاستجواب العديد من جوانب بيولوجيا Strongyloides. تفتقر الديدان الخيطية الطفيلية الأخرى إلى جيل يعيش بحرية ، ونتيجة لذلك ، فهي ليست قابلة بسهولة للتقنيات الجينومية الوظيفية3.
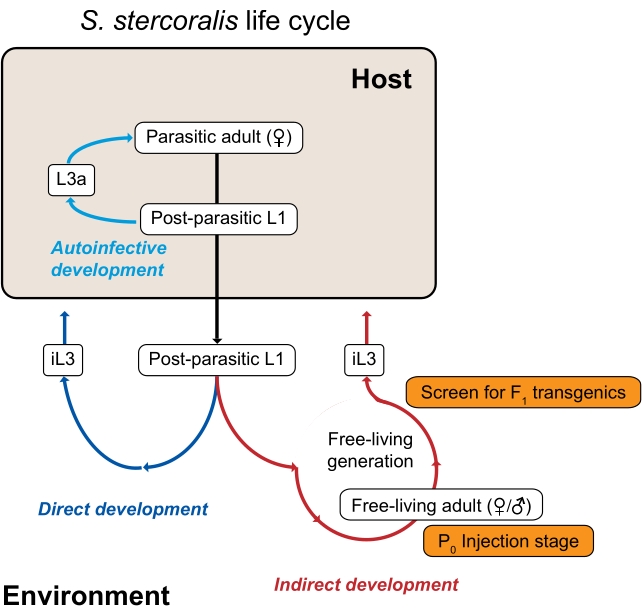
الشكل 1: دورة حياة سترونغيلويدات ستيركوراليس. تعيش الإناث الطفيلية S. stercoralis في الأمعاء الدقيقة لمضيفيها من الثدييات (البشر ، الرئيسيات غير البشرية ، الكلاب). تتكاثر الإناث الطفيلية عن طريق التوالد العذري وتضع البيض داخل الأمعاء الدقيقة. يفقس البيض بينما لا يزال داخل المضيف إلى يرقات ما بعد الطفيلية ، والتي يتم تمريرها بعد ذلك إلى البيئة مع البراز. إذا كانت يرقات ما بعد الطفيليات من الذكور ، فإنها تتطور إلى ذكور بالغين يعيشون بحرية. إذا كانت يرقات ما بعد الطفيلية أنثى ، فيمكنها إما أن تتطور إلى إناث بالغات يعشن بحرية (تطور غير مباشر) أو يرقات معدية في المرحلة الثالثة (iL3s ؛ تطور مباشر). الذكور والإناث الذين يعيشون بحرية يتكاثرون جنسيا لخلق ذرية مقيدة لتصبح iL3s. في ظل ظروف معينة ، يمكن أن يخضع S. stercoralis أيضا للعدوى الذاتية ، حيث تبقى بعض يرقات ما بعد الطفيلية داخل الأمعاء المضيفة بدلا من المرور إلى البيئة في البراز. يمكن أن تتطور هذه اليرقات إلى يرقات ذاتية العدوى (L3a) داخل المضيف ، وتخترق جدار الأمعاء ، وتهاجر عبر الجسم ، وتعود في النهاية إلى الأمعاء لتصبح بالغين تناسليين. دورة حياة S. ratti متشابهة ، باستثناء أن S. ratti يصيب الفئران وليس لديه دورة عدوى ذاتية. الجيل البيئي هو المفتاح لاستخدام أنواع Strongyloides للدراسات الوراثية. يمكن حقن الإناث البالغات اللواتي يعشن بحرية (P0) بشكل مجهري ؛ ذريتهم ، والتي ستصبح جميعها iL3s ، هي المعدلة وراثيا F1 المحتملة. وقد عدل هذا الرقم من كاستيليتو وآخرين. 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تشترك S. stercoralis في العديد من جوانب بيولوجيتها مع الديدان الخيطية الطفيلية البشرية المعدية المعوية الأخرى ، بما في ذلك غزو المضيف وتعديل المناعة المضيفة. على سبيل المثال ، تصيب الديدان الخطافية البشرية الطفيلية في الأجناس Necator و Ancylostoma أيضا عن طريق اختراق الجلد ، وتتنقل بالمثل عبر الجسم ، وتقيم في النهاية كبالغين طفيليين في الأمعاء الدقيقة7. وبالتالي ، من المحتمل أن تستخدم العديد من الديدان الخيطية المعدية المعوية السلوكيات الحسية الشائعة وتقنيات التهرب المناعي. ونتيجة لذلك ، فإن المعرفة المستقاة من Strongyloides ستكمل النتائج في الديدان الخيطية الأخرى الأقل قابلية للسحب وراثيا وتؤدي إلى فهم أكثر اكتمالا لهذه الطفيليات المعقدة والمهمة.
يحدد بروتوكول الحقن المجهري هذا طريقة إدخال الحمض النووي في الإناث البالغات اللواتي يعشن بحرية في Strongyloides لصنع ذرية معدلة وراثيا ومتحولة. يتم وصف متطلبات صيانة السلالة ، بما في ذلك التوقيت التنموي للديدان البالغة للحقن المجهري وجمع النسل المعدل وراثيا. يتم تضمين البروتوكولات وعرض توضيحي لتقنية الحقن المجهري الكاملة ، إلى جانب بروتوكولات زراعة وفحص النسل المعدل وراثيا ، إلى جانب قائمة بجميع المعدات والمواد الاستهلاكية اللازمة.
Protocol
Representative Results
Discussion
يفصل بروتوكول الحقن المجهري هذا طرق إدخال تركيبات للطفرات العابرة و CRISPR / Cas9 بوساطة في S. stercoralis و S . ratti. بالنسبة لكل من S. stercoralis و S . ratti ، يخضع البقاء على قيد الحياة بعد الحقن ومعدل التحول أو الطفرات لعدة متغيرات يمكن ضبطها بدقة.
أول اعتبار حاسم للتحول الناج…
Disclosures
The authors have nothing to disclose.
Acknowledgements
كانت pPV540 و pPV402 هدايا طيبة من الدكتور جيمس لوك في جامعة بنسلفانيا. نشكر أسترا براينت على تعليقاتها المفيدة على المخطوطة. تم تمويل هذا العمل من قبل باحثي صندوق بوروز ويلكوم في جائزة التسبب في الأمراض ، وجائزة الباحث في معهد هوارد هيوز الطبي ، والمعاهد الوطنية للصحة R01 DC017959 (E.A.H).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

