Generazione di transgenici e knockout in specie di Strongyloides mediante microiniezione
Summary
Il toolkit genomico funzionale per i nematodi parassiti Strongyloides stercoralis e Strongyloides ratti comprende transgenesi, mutagenesi mediata da CRISPR/Cas9 e RNAi. Questo protocollo dimostrerà come utilizzare la microiniezione intragonennale per introdurre transgeni e componenti CRISPR in S. stercoralis e S. ratti.
Abstract
Il genere Strongyloides è costituito da più specie di nematodi penetranti nella pelle con diverse gamme di ospiti, tra cui Strongyloides stercoralis e Strongyloides ratti. S. stercoralis è un nematode umano-parassitario, penetrante nella pelle che infetta circa 610 milioni di persone, mentre il parassita del ratto S. ratti è strettamente correlato a S. stercoralis ed è spesso usato come modello di laboratorio per S. stercoralis. Sia S. stercoralis che S. ratti sono facilmente suscettibili alla generazione di transgenici e knockout attraverso la tecnica di somministrazione esogena di acido nucleico della microiniezione intragonadiale e, come tali, sono emersi come sistemi modello per altri elminti parassiti che non sono ancora suscettibili a questa tecnica.
Gli adulti parassiti di Strongyloides abitano l’intestino tenue del loro ospite e rilasciano la progenie nell’ambiente attraverso le feci. Una volta nell’ambiente, le larve si sviluppano in adulti che vivono liberi, che vivono nelle feci e producono progenie che deve trovare e invadere un nuovo ospite. Questa generazione ambientale è unica per la specie Strongyloides e abbastanza simile nella morfologia al modello di nematode a vita libera Caenorhabditis elegans che le tecniche sviluppate per C. elegans possono essere adattate per l’uso con questi nematodi parassiti, compresa la microiniezione intragonadiale. Utilizzando la microiniezione intragonadiale, un’ampia varietà di transgeni può essere introdotta in Strongyloides. I componenti CRISPR/Cas9 possono anche essere microiniettati per creare larve mutanti di Strongyloides . Qui, viene descritta la tecnica di microiniezione intragonennale in Strongyloides, compresa la preparazione di adulti liberi, la procedura di iniezione e la selezione della progenie transgenica. Sono incluse immagini di larve transgeniche di Strongyloides create utilizzando la mutagenesi CRISPR/Cas9. Lo scopo di questo documento è quello di consentire ad altri ricercatori di utilizzare la microiniezione per creare Strongyloides transgenici e mutanti.
Introduction
Strongyloides stercoralis è stato a lungo trascurato come un importante agente patogeno umano rispetto agli anchilostomi più ampiamente riconosciuti e al nematode Ascaris lumbricoides1. Precedenti studi sul carico di vermi spesso hanno gravemente sottovalutato la prevalenza di S. stercoralis a causa della bassa sensibilità dei metodi diagnostici comuni per S. stercoralis2. Negli ultimi anni, studi epidemiologici basati su strumenti diagnostici migliorati hanno stimato che la vera prevalenza delle infezioni da S. stercoralis è molto più alta di quanto precedentemente riportato, circa 610 milioni di persone in tutto il mondo2.
Sia S. stercoralis che altre specie di Strongyloides, tra cui il parassita di ratto strettamente correlato e il comune modello di laboratorio S. ratti, hanno un ciclo di vita insolito che è vantaggioso per gli studi genomici sperimentali perché consiste di generazioni sia parassitarie che libere viventi (ambientali)3 (Figura 1). In particolare, sia S. stercoralis che S. ratti possono attraversare un’unica generazione di vita libera. La generazione a vita libera è costituita da larve post-parassitarie che si sviluppano in maschi e femmine adulti che vivono liberi; tutta la progenie degli adulti che vivono liberi si sviluppa in larve infettive, che devono infettare un ospite per continuare il ciclo di vita. Inoltre, questa generazione ambientale o di vita libera può essere manipolata sperimentalmente in laboratorio. Poiché gli adulti Strongyloides a vita libera e gli adulti C. elegans condividono una morfologia simile, tecniche come la microiniezione intragonennale originariamente sviluppate per C. elegans possono essere adattate per l’uso con Strongyloides 4,5 adulti a vita libera. Mentre il DNA viene generalmente introdotto nelle femmine adulte che vivono liberamente, sia i maschi che le femmine di Strongyloides possono essere microiniettati6. Pertanto, sono disponibili strumenti genomici funzionali per interrogare molti aspetti della biologia di Strongyloides. Altri nematodi parassiti mancano di una generazione di vita libera e, di conseguenza, non sono così facilmente suscettibili alle tecniche genomiche funzionali3.
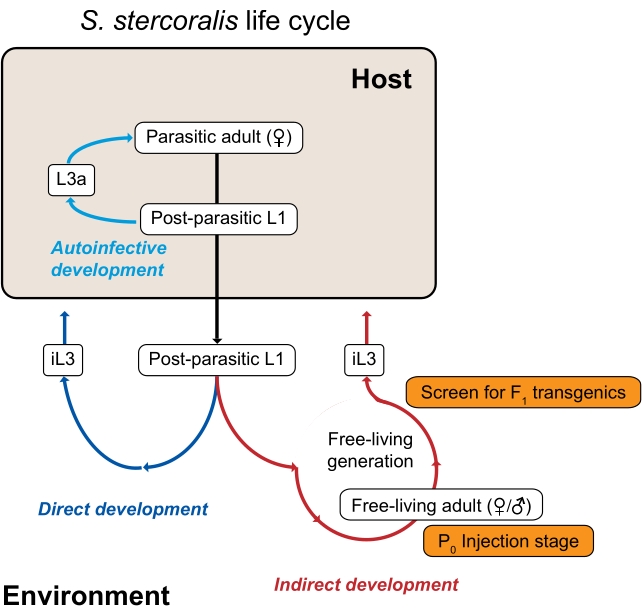
Figura 1: Il ciclo di vita di Strongyloides stercoralis. Le femmine parassitarie di S. stercoralis abitano l’intestino tenue dei loro ospiti mammiferi (umani, primati non umani, cani). Le femmine parassitarie si riproducono per partenogenesi e depongono le uova all’interno dell’intestino tenue. Le uova si schiudono mentre sono ancora all’interno dell’ospite in larve post-parassitarie, che vengono poi passate nell’ambiente con le feci. Se le larve post-parassitarie sono maschi, si sviluppano in maschi adulti che vivono liberamente. Se le larve post-parassitarie sono femmine, possono svilupparsi in femmine adulte a vita libera (sviluppo indiretto) o larve infettive di terzo stadio (iL3s; sviluppo diretto). I maschi e le femmine che vivono liberi si riproducono sessualmente per creare progenie che sono costretti a diventare iL3. In determinate condizioni, S. stercoralis può anche subire l’autoinfezione, in cui alcune delle larve post-parassitarie rimangono all’interno dell’intestino ospite piuttosto che passare nell’ambiente nelle feci. Queste larve possono svilupparsi in larve autoinfettive (L3a) all’interno dell’ospite, penetrare attraverso la parete intestinale, migrare attraverso il corpo e alla fine tornare all’intestino per diventare adulti riproduttivi. Il ciclo di vita di S. ratti è simile, tranne che S. ratti infetta i ratti e non ha un ciclo autoinfettivo. La generazione ambientale è la chiave per l’utilizzo delle specie di Strongyloides per studi genetici. Le femmine adulte a vita libera (P0) possono essere microintetate; la loro progenie, che diventerà tutta iL3, sono i potenziali transgenici F1. Questa figura è stata modificata da Castelletto et al. 3. Fare clic qui per visualizzare una versione più grande di questa figura.
S. stercoralis condivide molti aspetti della sua biologia con altri nematodi gastrointestinali parassiti umani, tra cui l’invasione dell’ospite e la modulazione immunitaria dell’ospite. Ad esempio, gli anchilostomi umani-parassiti nei generi Necator e Ancylostoma infettano anche la penetrazione della pelle, navigano in modo simile attraverso il corpo e, infine, risiedono come adulti parassiti nell’intestino tenue7. Pertanto, molti nematodi gastrointestinali probabilmente utilizzano comportamenti sensoriali comuni e tecniche di evasione immunitaria. Di conseguenza, le conoscenze raccolte da Strongyloides completeranno i risultati in altri nematodi meno trattabili geneticamente e porteranno a una comprensione più completa di questi parassiti complessi e importanti.
Questo protocollo di microiniezione delinea il metodo per introdurre il DNA nelle femmine adulte viventi libere di Strongyloides per produrre progenie transgenica e mutante. Vengono descritti i requisiti di mantenimento del ceppo, compresi i tempi di sviluppo dei vermi adulti per le microiniezioni e la raccolta della progenie transgenica. Sono inclusi protocolli e una dimostrazione della tecnica completa di microiniezione, insieme ai protocolli per la coltura e lo screening della progenie transgenica, insieme a un elenco di tutte le attrezzature e i materiali di consumo necessari.
Protocol
Representative Results
Discussion
Questo protocollo di microiniezione descrive in dettaglio i metodi per introdurre costrutti per la transgenesi e la mutagenesi mediata da CRISPR / Cas9 in S. stercoralis e S. ratti. Sia per S. stercoralis che per S. ratti, la sopravvivenza post-iniezione e il tasso di transgenesi o mutagenesi sono soggetti a diverse variabili che possono essere messe a punto.
La prima considerazione critica per una transgenesi di successo è come sono costruiti i transgeni …
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540 e pPV402 sono stati regali gentili del Dr. James Lok dell’Università della Pennsylvania. Ringraziamo Astra Bryant per i commenti utili sul manoscritto. Questo lavoro è stato finanziato da un Burroughs-Wellcome Fund Investigators in the Pathogenesis of Disease Award, un Howard Hughes Medical Institute Faculty Scholar Award e National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

