マイクロインジェクションによる ストロンギロイデス 種におけるトランスジェニックとノックアウトの生成
Summary
寄生性線虫 Strongyloides stercoralis および Strongyloides ratti のための機能的ゲノムツールキットには、トランスジェネシス、CRISPR/Cas9媒介突然変異誘発、およびRNAiが含まれる。このプロトコルは、生殖腺内マイクロインジェクションを使用して、導入遺伝子およびCRISPR成分を S. stercoralis および S. rattiに導入する方法を実証する。
Abstract
ストロンギロイデス属は、ストロンギロイデス・ステロイドおよびストロンギロイデス・ラティを含む、異なる宿主範囲を有する皮膚貫通線虫の複数種からなる。S. stercoralisは、約6億1000万人に感染するヒト寄生性の皮膚透過性線虫であり、ラット寄生虫S. rattiはS. stercoralisと密接に関連しており、S. stercoralisの実験室モデルとしてしばしば使用されている。 S. stercoralisとS. rattiの両方は、生殖腺内マイクロインジェクションの外因性核酸送達技術によるトランスジェニックおよびノックアウトの生成に容易に順応性であり、したがって、この技術にまだ順応していない他の寄生性蠕虫のモデルシステムとして浮上している。
寄生性 ストロンギロイデス 成虫は宿主の小腸に生息し、糞便を介して子孫を環境に放出する。環境に入ると、幼虫は糞便に住み、新しい宿主を見つけて侵入しなければならない子孫を産む自由生活の成虫に発達する。この環境生成は ストロンギロイデス 種に特有のものであり、モデルの自由生活線虫 Caenorhabditis elegansに形態が十分に類似しており、 C. elegans のために開発された技術は、性腺内マイクロインジェクションを含むこれらの寄生性線虫での使用に適合させることができる。生殖腺内マイクロインジェクションを用いて、多種多様な導入遺伝子を ストロンギロイデスに導入することができる。CRISPR/Cas9成分をマイクロインジェクションして、変異型 ストロンギロイデス 幼虫を作成することもできる。ここでは、自由生存成人の調製、注射手順、およびトランスジェニック子孫の選択を含む、 ストロンギロイデス への性腺内マイクロインジェクションの技術について説明する。CRISPR/Cas9突然変異誘発を用いて作製されたトランスジェニックスト ロンギロイデス 幼虫の画像が含まれる。この論文の目的は、他の研究者がマイクロインジェクションを使用してトランスジェニックおよび変異型の ストロンギロイデスを作成できるようにすることです。
Introduction
ストロンギロイデス・ステコラリスは、より広く認識されている鉤虫や回虫のアスカリス・ルンブリコイデス1と比較して、重要なヒト病原体として長い間見過ごされてきた。ワームの負担に関する以前の研究では、S.スターコラリス2の一般的な診断方法の感度が低いため、S.スターコラリスの有病率をしばしばひどく過小評価していました。近年、改良された診断ツールに基づく疫学的研究は、S.ステルコラリス感染症の真の有病率は、以前に報告されたよりもはるかに高く、世界中で約6億1000万人と推定されている2。
S. stercoralisと他のストロンギロイデス種(近縁のラット寄生虫および共通ラボモデルS. rattiを含む)は、寄生世代と自由生活(環境)世代の両方からなるため、実験的ゲノム研究に有利な異常なライフサイクルを持っています3(図1)。具体的には、S. stercoralisとS. rattiの両方が単一の自由生活世代を循環させることができます。自由生活世代は、自由生活の成人男性と女性に発達する寄生後の幼虫からなる。自由生活の成虫のすべての子孫は感染性の幼虫に発達し、ライフサイクルを継続するために宿主に感染しなければならない。さらに、この環境世代または自由生活世代は、実験室で実験的に操作することができる。自由生活のストロンギロイデス成虫とC.エレガンス成虫は類似の形態を共有しているため、もともとC.エレガンスのために開発された性腺内マイクロインジェクションなどの技術は、自由生活の成体ストロンギロイデス4,5での使用に適合させることができる。DNAは一般に自由生活の成人女性に導入されるが、ストロンギロイデスの男性と女性の両方にマイクロインジェクションすることができる6。したがって、機能的ゲノムツールは、ストロンギロイデスの生物学の多くの側面を調査するために利用可能である。他の寄生性線虫は自由生活世代を欠いており、その結果、機能的ゲノム技術に容易に順応していない3。
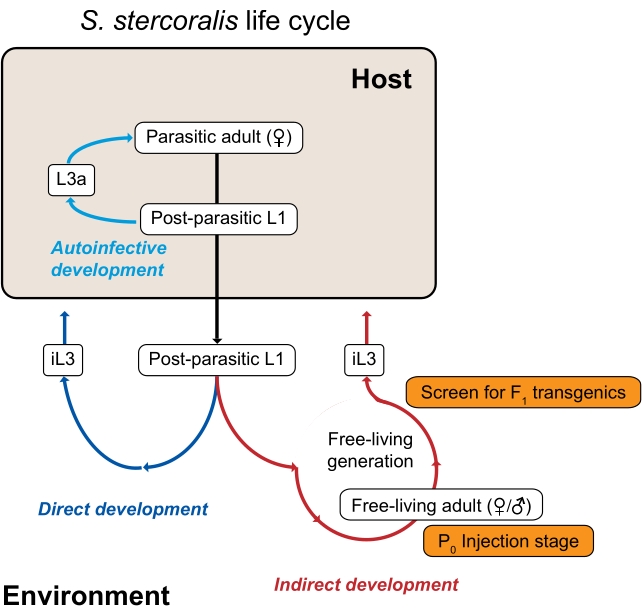
図1:ストロンギロイデス・ステロイドのライフサイクル S.ステルコラリス寄生雌は、哺乳類宿主(ヒト、非ヒト霊長類、イヌ)の小腸に生息する。寄生雌は単為生殖によって繁殖し、小腸内で卵を産む。卵は宿主の内部に留まっている間に孵化し、寄生後幼虫に孵化し、糞便とともに環境に渡される。寄生後の幼虫が雄である場合、それらは自由生活の成人男性に発達する。寄生後幼虫が雌である場合、それらは自由生活の成体雌(間接発達)または第3段階の感染性幼虫(iL3s;直接発達)のいずれかに発達することができる。自由生活の男性と女性は、iL3になるように制約されている子孫を作り出すために性的に繁殖します。特定の条件下では、S. stercoralisはまた、寄生後幼虫の一部が糞便中の環境に入るのではなく宿主腸内に留まる自己感染を受ける可能性がある。これらの幼虫は、宿主内で自己感染性幼虫(L3a)に発達し、腸壁を貫通し、体内を移動し、最終的に腸に戻って生殖成虫になることができる。S. rattiの生活環は、S. rattiがラットに感染し、自己感染サイクルを持たないことを除いて、類似している。環境生成は、遺伝学的研究にストロンギロイデス種を使用するための鍵です。自由生活の成人女性(P0)にはマイクロインジェクションすることができます。それらの子孫は、すべてiL3sになり、潜在的なF1遺伝子導入薬である。この図はカステルレットらから修正されたものである。3. この図の拡大版を表示するには、ここをクリックしてください。
S. stercoralisは 、宿主の侵入や宿主の免疫調節を含む他の胃腸ヒト寄生性線虫と生物学の多くの側面を共有しています。例えば、 Necator 属および Ancylostoma 属のヒト寄生性鉤虫も皮膚浸透によって感染し、同様に体内をナビゲートし、そして最終的には小腸に寄生成体として存在する7。したがって、多くの胃腸線虫は、一般的な感覚行動および免疫回避技術を使用する可能性が高い。その結果、 ストロンギロイデス から集められた知識は、他の遺伝的に扱いにくい線虫の発見を補完し、これらの複雑で重要な寄生虫のより完全な理解につながるでしょう。
このマイクロインジェクションプロトコルは、トランスジェニックおよび突然変異体の子孫を作るために 、ストロンギロイデス の自由生活の成人女性にDNAを導入する方法を概説しています。マイクロインジェクションのための成虫の発生時期およびトランスジェニック子孫の収集を含む、株維持要件が記載されている。プロトコルと完全なマイクロインジェクション技術のデモンストレーション、トランスジェニック子孫の培養とスクリーニングのためのプロトコルが、必要なすべての機器と消耗品のリストとともに含まれています。
Protocol
Representative Results
Discussion
このマイクロインジェクションプロトコルは、トランスジェネシスおよびCRISPR/Cas9媒介突然変異誘発のための構築物を S. stercoralis および S. ratti に導入するための方法を詳述する。S. stercoralis と S. rattiの両方について、注射後の生存率およびトランスジェネシスまたは突然変異誘発の速度は、微調整可能ないくつかの変数の影響を受けます。
ト?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540とpPV402は、ペンシルベニア大学のジェームズ・ロック博士からの親切な贈り物でした。原稿に関する有益なコメントをくれたAstra Bryantに感謝します。この研究は、バローズ・ウェルカム基金の研究者から、疾患の病因賞、ハワード・ヒューズ医学研究所教員奨学生賞、国立衛生研究所R01 DC017959(E.A.H.)から資金提供を受けました。
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

