Generación de transgénicos y knockouts en especies de Strongyloides por microinyección
Summary
El kit de herramientas genómicas funcionales para los nematodos parásitos Strongyloides stercoralis y Strongyloides ratti incluye transgénesis, mutagénesis mediada por CRISPR / Cas9 y ARNi. Este protocolo demostrará cómo utilizar la microinyección intragonadal para introducir transgenes y componentes CRISPR en S. stercoralis y S. ratti.
Abstract
El género Strongyloides consiste en múltiples especies de nematodos penetrantes en la piel con diferentes rangos de huéspedes, incluyendo Strongyloides stercoralis y Strongyloides ratti. S. stercoralis es un nematodo parásito de la piel que penetra en la piel y que infecta a aproximadamente 610 millones de personas, mientras que el parásito de la rata S. ratti está estrechamente relacionado con S. stercoralis y se usa a menudo como modelo de laboratorio para S. stercoralis. Tanto S. stercoralis como S. ratti son fácilmente susceptibles a la generación de transgénicos y knockouts a través de la técnica de administración de ácido nucleico exógeno de microinyección intragonadal, y como tales, han surgido como sistemas modelo para otros helmintos parásitos que aún no son susceptibles a esta técnica.
Los adultos parásitos de Strongyloides habitan en el intestino delgado de su huésped y liberan progenie en el medio ambiente a través de las heces. Una vez en el medio ambiente, las larvas se convierten en adultos de vida libre, que viven en heces y producen progenie que debe encontrar e invadir un nuevo huésped. Esta generación ambiental es exclusiva de la especie Strongyloides y lo suficientemente similar en morfología al nematodo modelo de vida libre Caenorhabditis elegans que las técnicas desarrolladas para C. elegans se pueden adaptar para su uso con estos nematodos parásitos, incluida la microinyección intragonadal. Usando microinyección intragonadal, se puede introducir una amplia variedad de transgenes en Strongyloides. Los componentes CRISPR/Cas9 también pueden ser microinyectados para crear larvas mutantes de Strongyloides . Aquí, se describe la técnica de microinyección intragonadal en Strongyloides, incluida la preparación de adultos de vida libre, el procedimiento de inyección y la selección de la progenie transgénica. Se incluyen imágenes de larvas transgénicas de Strongyloides creadas mediante mutagénesis CRISPR/Cas9. El objetivo de este artículo es permitir a otros investigadores utilizar la microinyección para crear Strongyloides transgénicos y mutantes.
Introduction
Strongyloides stercoralis se ha pasado por alto durante mucho tiempo como un patógeno humano importante en comparación con los anquilostomas más ampliamente reconocidos y el gusano redondo Ascaris lumbricoides1. Los estudios previos sobre la carga de gusanos a menudo subestimaron gravemente la prevalencia de S. stercoralis debido a la baja sensibilidad de los métodos de diagnóstico comunes para S. stercoralis2. En los últimos años, estudios epidemiológicos basados en herramientas diagnósticas mejoradas han estimado que la verdadera prevalencia de infecciones por S. stercoralis es mucho mayor que la reportada anteriormente, aproximadamente 610 millones de personas en todo el mundo2.
Tanto S. stercoralis como otras especies de Strongyloides, incluido el parásito de rata estrechamente relacionado y el modelo de laboratorio común S. ratti, tienen un ciclo de vida inusual que es ventajoso para los estudios genómicos experimentales porque consiste en generaciones parásitas y de vida libre (ambientales)3 (Figura 1). Específicamente, tanto S. stercoralis como S. ratti pueden pasar por una sola generación de vida libre. La generación de vida libre consiste en larvas post-parásitas que se convierten en machos y hembras adultos de vida libre; toda la progenie de los adultos de vida libre se convierte en larvas infecciosas, que deben infectar a un huésped para continuar el ciclo de vida. Además, esta generación ambiental o de vida libre puede ser manipulada experimentalmente en el laboratorio. Debido a que los adultos de Strongyloides de vida libre y los adultos de C. elegans comparten una morfología similar, las técnicas como la microinyección intragonadal que se desarrollaron originalmente para C. elegans se pueden adaptar para su uso con Strongyloides adultos de vida libre 4,5. Mientras que el ADN generalmente se introduce en hembras adultas de vida libre, tanto los machos como las hembras de Strongyloides pueden ser microinyectados6. Por lo tanto, las herramientas genómicas funcionales están disponibles para interrogar muchos aspectos de la biología de Strongyloides. Otros nematodos parásitos carecen de una generación de vida libre y, como resultado, no son tan fácilmente susceptibles a las técnicas genómicas funcionales3.
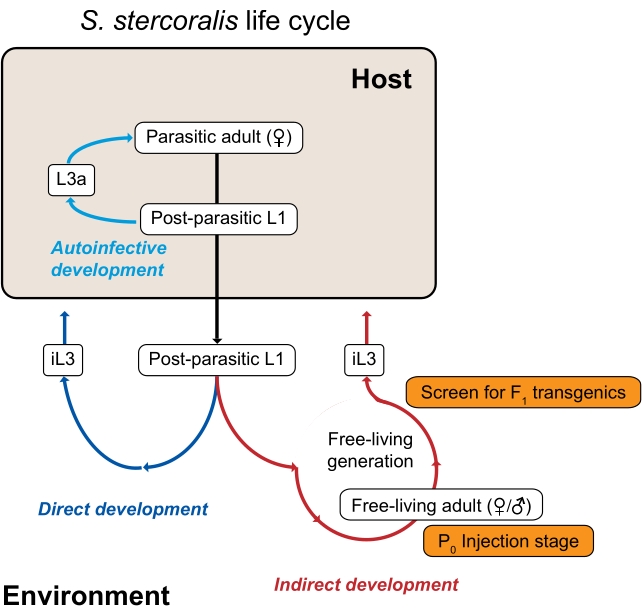
Figura 1: El ciclo de vida de Strongyloides stercoralis. Las hembras parásitas de S. stercoralis habitan el intestino delgado de sus huéspedes mamíferos (humanos, primates no humanos, perros). Las hembras parásitas se reproducen por partenogénesis y ponen huevos dentro del intestino delgado. Los huevos eclosionan mientras aún están dentro del huésped en larvas post-parásitas, que luego se pasan al medio ambiente con heces. Si las larvas postparasitarias son machos, se convierten en machos adultos de vida libre. Si las larvas postparasitarias son hembras, pueden convertirse en hembras adultas de vida libre (desarrollo indirecto) o larvas infecciosas de tercera etapa (iL3s; desarrollo directo). Los machos y hembras de vida libre se reproducen sexualmente para crear progenie que se ve limitada a convertirse en iL3s. Bajo ciertas condiciones, S. stercoralis también puede someterse a una autoinfección, en la que algunas de las larvas postparasitarias permanecen dentro del intestino del huésped en lugar de pasar al medio ambiente en las heces. Estas larvas pueden convertirse en larvas autoinfectivas (L3a) dentro del huésped, penetrar a través de la pared intestinal, migrar a través del cuerpo y, finalmente, regresar al intestino para convertirse en adultos reproductivos. El ciclo de vida de S. ratti es similar, excepto que S. ratti infecta a las ratas y no tiene un ciclo autoinfectivo. La generación ambiental es clave para el uso de especies de Strongyloides para estudios genéticos. Las hembras adultas de vida libre (P0) pueden ser microinyectadas; su progenie, que se convertirá en iL3, son los potenciales transgénicos F1. Esta figura ha sido modificada a partir de Castelletto et al. 3. Haga clic aquí para ver una versión más grande de esta figura.
S. stercoralis comparte muchos aspectos de su biología con otros nematodos parásitos humanos gastrointestinales, incluida la invasión del huésped y la modulación inmune del huésped. Por ejemplo, los anquilostomas parásitos humanos en los géneros Necator y Ancylostoma también infectan por penetración en la piel, navegan de manera similar a través del cuerpo y, en última instancia, residen como adultos parásitos en el intestino delgado7. Por lo tanto, muchos nematodos gastrointestinales probablemente usan comportamientos sensoriales comunes y técnicas de evasión inmune. Como resultado, el conocimiento obtenido de Strongyloides complementará los hallazgos en otros nematodos menos tratables genéticamente y conducirá a una comprensión más completa de estos parásitos complejos e importantes.
Este protocolo de microinyección describe el método para introducir ADN en hembras adultas de vida libre de Strongyloides para producir progenie transgénica y mutante. Se describen los requisitos de mantenimiento de la cepa, incluido el momento de desarrollo de los gusanos adultos para microinyecciones y la recolección de progenie transgénica. Se incluyen protocolos y una demostración de la técnica completa de microinyección, junto con protocolos para el cultivo y detección de progenie transgénica, junto con una lista de todos los equipos y consumibles necesarios.
Protocol
Representative Results
Discussion
Este protocolo de microinyección detalla los métodos para introducir constructos para la transgénesis y la mutagénesis mediada por CRISPR/Cas9 en S. stercoralis y S. ratti. Tanto para S. stercoralis como para S. ratti, la supervivencia posterior a la inyección y la tasa de transgénesis o mutagénesis están sujetas a varias variables que pueden ajustarse.
La primera consideración crítica para una transgénesis exitosa es cómo se construyen los tran…
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540 y pPV402 fueron amables regalos del Dr. James Lok de la Universidad de Pensilvania. Agradecemos a Astra Bryant por sus útiles comentarios sobre el manuscrito. Este trabajo fue financiado por un Burroughs-Wellcome Fund Investigators in the Pathogenesis of Disease Award, un Howard Hughes Medical Institute Faculty Scholar Award y National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

