Génération de transgéniques et de Knockouts chez les espèces de strongyloïdes par microinjection
Summary
La boîte à outils génomique fonctionnelle pour les nématodes parasites Strongyloides stercoralis et Strongyloides ratti comprend la transgénèse, la mutagénèse médiée par CRISPR / Cas9 et l’ARNi. Ce protocole montrera comment utiliser la microinjection intragonadienne pour introduire des transgènes et des composants CRISPR dans S. stercoralis et S. ratti.
Abstract
Le genre Strongyloides se compose de plusieurs espèces de nématodes pénétrant dans la peau avec différentes gammes d’hôtes, y compris Strongyloides stercoralis et Strongyloides ratti. S. stercoralis est un nématode parasite humain, pénétrant dans la peau, qui infecte environ 610 millions de personnes, tandis que le parasite du rat S. ratti est étroitement lié à S. stercoralis et est souvent utilisé comme modèle de laboratoire pour S. stercoralis. S. stercoralis et S. ratti se prêtent facilement à la génération de transgéniques et de knockouts grâce à la technique exogène d’administration d’acides nucléiques de la microinjection intragonadale et, en tant que tels, sont devenus des systèmes modèles pour d’autres helminthes parasites qui ne se prêtent pas encore à cette technique.
Les adultes parasites Strongyloides habitent l’intestin grêle de leur hôte et libèrent de la progéniture dans l’environnement via les matières fécales. Une fois dans l’environnement, les larves se développent en adultes libres, qui vivent dans les excréments et produisent une progéniture qui doit trouver et envahir un nouvel hôte. Cette génération environnementale est unique à l’espèce Strongyloides et sa morphologie est suffisamment similaire à celle du nématode vivant librement Caenorhabditis elegans pour que les techniques développées pour C. elegans puissent être adaptées pour être utilisées avec ces nématodes parasites, y compris la microinjection intragonadaire. En utilisant la microinjection intragonadienne, une grande variété de transgènes peuvent être introduits dans Strongyloides. Les composants CRISPR/Cas9 peuvent également être microinjectés pour créer des larves mutantes de Strongyloides . Ici, la technique de microinjection intragonadale en Strongyloides, y compris la préparation d’adultes libres, la procédure d’injection et la sélection de la progéniture transgénique, est décrite. Des images de larves transgéniques de Strongyloides créées à l’aide de la mutagénèse CRISPR/Cas9 sont incluses. L’objectif de cet article est de permettre à d’autres chercheurs d’utiliser la microinjection pour créer des Strongyloides transgéniques et mutants.
Introduction
Strongyloides stercoralis a longtemps été négligé comme un agent pathogène humain important par rapport aux ankylostomes plus largement reconnus et au ver rond Ascaris lumbricoides1. Des études antérieures sur la charge de vers ont souvent gravement sous-estimé la prévalence de S. stercoralis en raison de la faible sensibilité des méthodes de diagnostic courantes pour S. stercoralis2. Au cours des dernières années, des études épidémiologiques basées sur des outils de diagnostic améliorés ont estimé que la prévalence réelle des infections à S. stercoralis est beaucoup plus élevée que ce qui avait été rapporté précédemment, soit environ 610 millions de personnes dans le monde2.
S. stercoralis et d’autres espèces de Strongyloides, y compris le parasite de rat étroitement apparenté et le modèle de laboratoire commun S. ratti, ont un cycle de vie inhabituel qui est avantageux pour les études génomiques expérimentales car il se compose à la fois de générations parasites et libres (environnementales)3 (Figure 1). Plus précisément, S. stercoralis et S. ratti peuvent traverser une seule génération de vie libre. La génération de la vie libre se compose de larves post-parasites qui se développent en mâles et femelles adultes libres; toutes les descendants des adultes libres se développent en larves infectieuses, qui doivent infecter un hôte pour poursuivre le cycle de vie. De plus, cette génération environnementale ou libre peut être manipulée expérimentalement en laboratoire. Étant donné que les adultes Strongyloides vivant en liberté et les adultes de C. elegans partagent une morphologie similaire, des techniques telles que la microinjection intragonadale qui ont été développées à l’origine pour C. elegans peuvent être adaptées pour être utilisées avec des Strongyloides 4,5 adultes vivant en liberté. Alors que l’ADN est généralement introduit chez les femelles adultes libres, les mâles et les femelles de Strongyloides peuvent être microinjectés6. Ainsi, des outils génomiques fonctionnels sont disponibles pour interroger de nombreux aspects de la biologie des Strongyloides. D’autres nématodes parasites n’ont pas de génération libre et, par conséquent, ne se prêtent pas aussi facilement aux techniques génomiques fonctionnelles3.
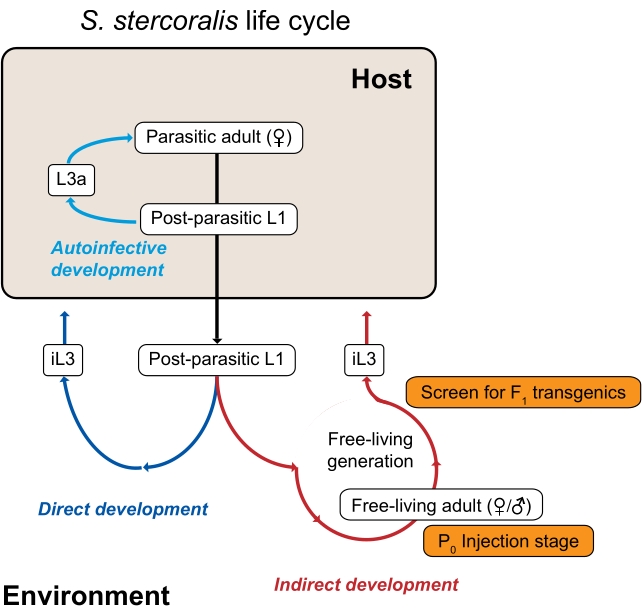
Figure 1 : Cycle de vie de Strongyloides stercoralis. Les femelles parasites de S. stercoralis habitent l’intestin grêle de leurs hôtes mammifères (humains, primates non humains, chiens). Les femelles parasites se reproduisent par parthénogenèse et pondent des œufs dans l’intestin grêle. Les œufs éclosent encore à l’intérieur de l’hôte en larves post-parasites, qui sont ensuite passées dans l’environnement avec des matières fécales. Si les larves post-parasites sont des mâles, elles se développent en mâles adultes libres. Si les larves postparasitaires sont des femelles, elles peuvent se développer en femelles adultes libres (développement indirect) ou en larves infectieuses de troisième stade (iL3s; développement direct). Les mâles et les femelles libres se reproduisent sexuellement pour créer une progéniture qui est contrainte de devenir des iL3. Dans certaines conditions, S. stercoralis peut également subir une auto-infection, dans laquelle certaines des larves postparasitaires restent à l’intérieur de l’intestin hôte plutôt que de passer dans l’environnement dans les matières fécales. Ces larves peuvent se développer en larves auto-infectieuses (L3a) à l’intérieur de l’hôte, pénétrer à travers la paroi intestinale, migrer à travers le corps et éventuellement retourner dans l’intestin pour devenir des adultes reproducteurs. Le cycle de vie de S. ratti est similaire, sauf que S. ratti infecte les rats et n’a pas de cycle auto-infectieux. La génération environnementale est essentielle à l’utilisation des espèces de Strongyloides pour les études génétiques. Les femelles adultes libres (P0) peuvent être microinjectées; leur progéniture, qui deviendront toutes des iL3, sont les transgéniques potentiels F1. Ce chiffre a été modifié à partir de Castelletto et al. 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
S. stercoralis partage de nombreux aspects de sa biologie avec d’autres nématodes gastro-intestinaux parasitaires humains, y compris l’invasion de l’hôte et la modulation immunitaire de l’hôte. Par exemple, les ankylostomes parasitaires humains des genres Necator et Ancylostoma infectent également par pénétration cutanée, naviguent de manière similaire dans le corps et résident finalement comme des adultes parasites dans l’intestin grêle7. Ainsi, de nombreux nématodes gastro-intestinaux utilisent probablement des comportements sensoriels courants et des techniques d’évasion immunitaire. En conséquence, les connaissances glanées auprès de Strongyloides compléteront les découvertes chez d’autres nématodes moins génétiquement traitables et conduiront à une compréhension plus complète de ces parasites complexes et importants.
Ce protocole de micro-injection décrit la méthode d’introduction de l’ADN dans les femelles adultes strongyloïdes vivant librement pour fabriquer une progéniture transgénique et mutante. Les exigences en matière d’entretien de la souche, y compris le calendrier de développement des vers adultes pour les microinjections et la collecte de la progéniture transgénique, sont décrites. Des protocoles et une démonstration de la technique complète de micro-injection, ainsi que des protocoles pour la culture et le dépistage de la progéniture transgénique, sont inclus, ainsi qu’une liste de tous les équipements et consommables nécessaires.
Protocol
Representative Results
Discussion
Ce protocole de microinjection détaille les méthodes d’introduction de constructions pour la transgénèse et la mutagénèse médiée par CRISPR/Cas9 chez S. stercoralis et S. ratti. Pour S. stercoralis et S. ratti, la survie post-injection et le taux de transgénèse ou de mutagénèse sont soumis à plusieurs variables qui peuvent être affinées.
La première considération critique pour une transgénèse réussie est la façon dont les transgènes …
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540 et pPV402 étaient de bons cadeaux du Dr James Lok de l’Université de Pennsylvanie. Nous remercions Astra Bryant pour ses commentaires utiles sur le manuscrit. Ce travail a été financé par un Burroughs-Wellcome Fund Investigators in the Pathogenesis of Disease Award, un Howard Hughes Medical Institute Faculty Scholar Award et National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

