Het genereren van transgenen en knock-outs in strongyloides soorten door micro-injectie
Summary
De functionele genomische toolkit voor de parasitaire nematoden Strongyloides stercoralis en Strongyloides ratti omvat transgenese, CRISPR/Cas9-gemedieerde mutagenese en RNAi. Dit protocol zal demonstreren hoe intragonadale micro-injectie kan worden gebruikt om transgenen en CRISPR-componenten in S. stercoralis en S. ratti te introduceren.
Abstract
Het geslacht Strongyloides bestaat uit meerdere soorten huiddoordringende nematoden met verschillende gastheerbereiken, waaronder Strongyloides stercoralis en Strongyloides ratti. S. stercoralis is een mens-parasitaire, huiddoordringende nematode die ongeveer 610 miljoen mensen infecteert, terwijl de rattenparasiet S. ratti nauw verwant is aan S. stercoralis en vaak wordt gebruikt als laboratoriummodel voor S. stercoralis. Zowel S. stercoralis als S. ratti zijn gemakkelijk vatbaar voor het genereren van transgenen en knock-outs door de exogene nucleïnezuurafgiftetechniek van intragonadale micro-injectie, en zijn als zodanig naar voren gekomen als modelsystemen voor andere parasitaire helminten die nog niet vatbaar zijn voor deze techniek.
Parasitaire Strongyloides-volwassenen bewonen de dunne darm van hun gastheer en geven nakomelingen via de ontlasting af aan de omgeving. Eenmaal in de omgeving ontwikkelen de larven zich tot vrijlevende volwassenen, die in uitwerpselen leven en nakomelingen produceren die een nieuwe gastheer moeten vinden en binnendringen. Deze milieugeneratie is uniek voor de Strongyloides-soorten en vergelijkbaar genoeg in morfologie met het model vrijlevende nematode Caenorhabditis elegans dat technieken ontwikkeld voor C. elegans kunnen worden aangepast voor gebruik met deze parasitaire nematoden, inclusief intragonadale micro-injectie. Met behulp van intragonadale micro-injectie kan een breed scala aan transgenen in Strongyloides worden geïntroduceerd. CRISPR/Cas9-componenten kunnen ook micro-geïnjecteerd worden om gemuteerde Strongyloides-larven te creëren. Hier wordt de techniek van intragonadale micro-injectie in Strongyloides beschreven, inclusief de bereiding van vrij levende volwassenen, de injectieprocedure en de selectie van transgene nakomelingen. Afbeeldingen van transgene Strongyloides-larven gemaakt met CRISPR / Cas9-mutagenese zijn opgenomen. Het doel van dit artikel is om andere onderzoekers in staat te stellen micro-injectie te gebruiken om transgene en mutante Strongyloides te creëren.
Introduction
Strongyloides stercoralis is lang over het hoofd gezien als een belangrijke menselijke ziekteverwekker in vergelijking met de meer algemeen erkende haakwormen en de rondworm Ascaris lumbricoides1. Eerdere studies naar wormbelasting onderschatten vaak de prevalentie van S. stercoralis vanwege de lage gevoeligheid van gangbare diagnostische methoden voor S. stercoralis2. In de afgelopen jaren hebben epidemiologische studies op basis van verbeterde diagnostische hulpmiddelen geschat dat de werkelijke prevalentie van S. stercoralis-infecties veel hoger is dan eerder gemeld, ongeveer 610 miljoen mensen wereldwijd2.
Zowel S. stercoralis als andere Strongyloides-soorten, waaronder de nauw verwante rattenparasiet en het gemeenschappelijke laboratoriummodel S. ratti, hebben een ongewone levenscyclus die voordelig is voor experimentele genomische studies omdat het bestaat uit zowel parasitaire als vrijlevende (milieu) generaties3 (figuur 1). Concreet kunnen zowel S. stercoralis als S. ratti door één vrijlevende generatie fietsen. De vrijlevende generatie bestaat uit postparasitaire larven die zich ontwikkelen tot vrijlevende volwassen mannetjes en vrouwtjes; alle nakomelingen van de vrij levende volwassenen ontwikkelen zich tot infectieuze larven, die een gastheer moeten infecteren om de levenscyclus voort te zetten. Bovendien kan deze milieu- of vrijlevende generatie experimenteel worden gemanipuleerd in het laboratorium. Omdat vrijlevende Strongyloides-volwassenen en C. elegans-volwassenen een vergelijkbare morfologie delen, kunnen technieken zoals intragonadale micro-injectie die oorspronkelijk werden ontwikkeld voor C. elegans worden aangepast voor gebruik met vrijlevende volwassen Strongyloides 4,5. Hoewel DNA over het algemeen wordt geïntroduceerd in vrijlevende volwassen vrouwtjes, kunnen zowel mannen als vrouwen van Strongyloides micro-geïnjecteerd worden6. Zo zijn functionele genomische hulpmiddelen beschikbaar om vele aspecten van de biologie van Strongyloides te ondervragen. Andere parasitaire nematoden missen een vrijlevende generatie en zijn daardoor niet zo gemakkelijk vatbaar voor functionele genomische technieken3.
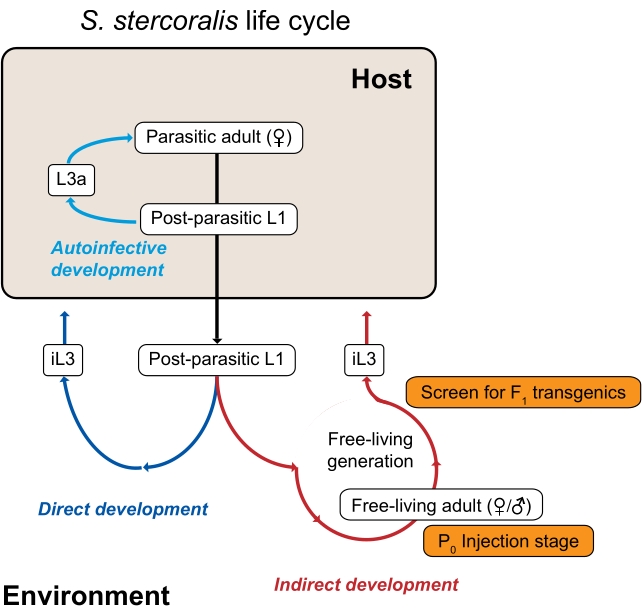
Figuur 1: De levenscyclus van Strongyloides stercoralis. De S. stercoralis parasitaire vrouwtjes bewonen de dunne darm van hun zoogdiergastheren (mensen, niet-menselijke primaten, honden). De parasitaire vrouwtjes reproduceren door parthenogenese en leggen eieren in de dunne darm. De eieren komen uit terwijl ze zich nog in de gastheer bevinden in postparasitaire larven, die vervolgens met uitwerpselen in de omgeving worden gebracht. Als de postparasitaire larven mannelijk zijn, ontwikkelen ze zich tot vrijlevende volwassen mannetjes. Als de postparasitaire larven vrouwelijk zijn, kunnen ze zich ontwikkelen tot vrijlevende volwassen vrouwtjes (indirecte ontwikkeling) of infectieve larven in het derde stadium (iL3s; directe ontwikkeling). De vrijlevende mannetjes en vrouwtjes planten zich seksueel voort om nakomelingen te creëren die gedwongen zijn om iL3’s te worden. Onder bepaalde omstandigheden kan S. stercoralis ook auto-infectie ondergaan, waarbij sommige van de postparasitaire larven in de darm van de gastheer blijven in plaats van in uitwerpselen in de omgeving te komen. Deze larven kunnen zich ontwikkelen tot auto-infectieuze larven (L3a) in de gastheer, doordringen door de darmwand, migreren door het lichaam en uiteindelijk terugkeren naar de darm om reproductieve volwassenen te worden. De levenscyclus van S. ratti is vergelijkbaar, behalve dat S. ratti ratten infecteert en geen auto-infectieve cyclus heeft. De milieugeneratie is de sleutel tot het gebruik van Strongyloides-soorten voor genetische studies. De vrij levende volwassen vrouwtjes (P0) kunnen micro-geïnjecteerd worden; hun nakomelingen, die allemaal iL3’s zullen worden, zijn de potentiële F 1-transgenen. Dit cijfer is aangepast van Castelletto et al. 3. Klik hier om een grotere versie van deze figuur te bekijken.
S. stercoralis deelt vele aspecten van zijn biologie met andere gastro-intestinale humaan-parasitaire nematoden, waaronder gastheerinvasie en gastheerimmuunmodulatie. Bijvoorbeeld, menselijk-parasitaire haakwormen in de geslachten Necator en Ancylostoma infecteren ook door huidpenetratie, navigeren op dezelfde manier door het lichaam en verblijven uiteindelijk als parasitaire volwassenen in de dunne darm7. Veel gastro-intestinale nematoden gebruiken dus waarschijnlijk gemeenschappelijk sensorisch gedrag en immuunontwijkingstechnieken. Als gevolg hiervan zal de kennis die is opgedaan bij Strongyloides de bevindingen in andere minder genetisch hanteerbare nematoden aanvullen en leiden tot een vollediger begrip van deze complexe en belangrijke parasieten.
Dit micro-injectieprotocol schetst de methode voor het introduceren van DNA in Strongyloides vrijlevende volwassen vrouwtjes om transgene en mutante nakomelingen te maken. De vereisten voor stamonderhoud, inclusief de ontwikkelingstijd van volwassen wormen voor micro-injecties en het verzamelen van transgene nakomelingen, worden beschreven. Protocollen en een demonstratie van de volledige micro-injectietechniek, samen met protocollen voor het kweken en screenen van transgene nakomelingen, zijn inbegrepen, samen met een lijst van alle benodigde apparatuur en verbruiksartikelen.
Protocol
Representative Results
Discussion
Dit micro-injectieprotocol beschrijft de methoden voor het introduceren van constructen voor transgenese en CRISPR/Cas9-gemedieerde mutagenese in S. stercoralis en S. ratti. Voor zowel S. stercoralis als S. ratti zijn de overleving na injectie en de snelheid van transgenese of mutagenese onderhevig aan verschillende variabelen die kunnen worden verfijnd.
De eerste kritische overweging voor succesvolle transgenese is hoe plasmidetransgenen worden geconstruee…
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540 en pPV402 waren vriendelijke geschenken van Dr. James Lok aan de Universiteit van Pennsylvania. Wij danken Astra Bryant voor de nuttige reacties op het manuscript. Dit werk werd gefinancierd door een Burroughs-Wellcome Fund Investigators in de Pathogenesis of Disease Award, een Howard Hughes Medical Institute Faculty Scholar Award en National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetics. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

