Chemiluminescentie-gebaseerde assays voor de detectie van stikstofmonoxide en zijn derivaten van autoxidatie en nitrosated compounds
Summary
Hier presenteren we protocollen voor het detecteren van stikstofmonoxide en zijn biologisch relevante derivaten met behulp van op chemiluminescentie gebaseerde assays met een hoge gevoeligheid.
Abstract
Stikstofmonoxide (NO) activiteit in vivo is de gecombineerde resultaten van de directe effecten, de werking van de derivaten gegenereerd door NO autoxidatie, en de effecten van nitrosated verbindingen. Het meten van NO-metabolieten is essentieel voor het bestuderen van NO-activiteit, zowel op vasculaire niveaus als in andere weefsels, vooral in de experimentele omgevingen waar exogene NO wordt toegediend. Op ozon gebaseerde chemiluminescentietests maken nauwkeurige metingen van NO- en NO-metabolieten mogelijk in zowel vloeistoffen (inclusief plasma, weefselhomogenaten, celculturen) als gasmengsels (bijv. Uitgeademde adem). NO reageert met ozon om stikstofdioxide te genereren in een aangeslagen toestand. De daaruit voortvloeiende lichtuitstraling maakt fotodetectie en het genereren van een elektrisch signaal mogelijk dat het NO-gehalte van het monster weerspiegelt. Aliquots uit hetzelfde monster kunnen worden gebruikt om specifieke NO-metabolieten te meten, zoals nitraat, nitriet, S-nitrosothiolen en ijzer-nitrosylcomplexen. Bovendien wordt NO geconsumeerd door celvrij hemoglobine ook gekwantificeerd met chemiluminescentieanalyse. Een illustratie van al deze technieken wordt gegeven.
Introduction
Sinds Salvador Moncada en Nobelprijswinnaars Robert Furchgott, Louis Ignarro en Ferid Murad stikstofmonoxide (NO) identificeerden als de eerder bekende endotheel-afgeleide relaxatiefactor (EDRF), is de centrale rol van NO vastgesteld in verschillende belangrijke mechanismen die zich uitstrekken over vasculaire biologie, neurowetenschappen, metabolisme en gastheerrespons 1,2,3,4,5,6,7 . Exogene toediening van NO-gas is een gevestigde behandeling geworden voor respiratoire insufficiëntie als gevolg van pulmonale hypertensie bij de pasgeborene8. Stikstofmonoxidegas is ook onderzocht voor de behandeling van respiratoir syncytieel virus (RSV) infectie, malaria en andere infectieuze ziekten, ischemie-reperfusieletsel en voor de preventie van acuut nierletsel bij patiënten die hartchirurgie ondergaan 9,10,11,12. De behoefte aan nauwkeurige meettechnieken om de niveaus van NO, de metabolieten en die van de doeleiwitten en -verbindingen te beoordelen, komt voort uit zowel mechanistische als interventionele studies.
Vanwege de hoge reactiviteit kan NO verschillende reacties ondergaan, afhankelijk van de biologische matrix waarin het wordt geproduceerd en / of vrijgegeven. Bij afwezigheid van hemoglobine (Hb) of andere oxy-hemoproteïnen wordt NO bijna volledig geoxideerd tot nitriet (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2– + H+
NO ondergaat eerst autoxidatie met moleculaire zuurstof (O2) om stikstofdioxide (NO2) te verkrijgen en reageert met NO2 zelf om dinitrogentrioxide te genereren (N2O3). Eén molecuul van N2O3 reageert met water (H2O) om twee moleculen van NO2– en een proton (H+)13 te vormen. In volbloed worden14,15, NO en NO2– snel omgezet in nitraat (NO3–) omdat deze moleculen gretig reageren met de geoxideerde heemgroepen van Hb [Hb-Fe2+-O2 of oxyhemoglobine (oxyHb)] tot NO3–. Deze reactie gaat gepaard met de overgang van de heemgroep naar de ijzertoestand [Hb-Fe3+ of methemoglobine (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
De barrière van de rode bloedcel (RBC) en de ruimte direct grenzend aan het endotheel zijn de belangrijkste factoren die deze reactie beperken en waardoor een klein deel van het NO dat door het endotheel vrijkomt, kan fungeren als EDRF16,17. In feite is bekend dat celvrij Hb in de bloedsomloop de vaatverwijding in experimentele en klinische omgevingen verstoort17,18. Binnen de RBC reageert, afhankelijk van oxygenatie en NO 2-concentratie, een deel van NO met deoxyhemoglobine (Hb-Fe2+) om ijzer-nitrosyl Hb (Hb-Fe2+-NO of HbNO) te vormen:
Hb-Fe2+ + NO → Hb-Fe2+-NO
In de RBC15,17 kan NO2– Hb-Fe3+ vormen door Hb-Fe2+ te verlagen wat leidt tot het vrijkomen van NO, wat op zijn beurt Hb-Fe2+-O 2 (bij voorkeur) of Hb-Fe2+ bindt.
De generatie van NO-derivaten moet niet strikt unidirectioneel worden beschouwd, aangezien NO kan worden geregenereerd uit NO2– en NO3– in verschillende weefsels en door verschillende enzymen (bijvoorbeeld door darmbacteriën of in mitochondriën, met name onder hypoxische omstandigheden)19,20.
Een variabele hoeveelheid geproduceerd (of toegediend) NO leidt tot de stroomafwaartse generatie van S-nitrosothiolen, voornamelijk door thioltransnitrosatie van N2O3 in aanwezigheid van een nucleofiel die een NO+ donortussenproduct creëert (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
Een andere mogelijkheid voor het genereren van S-nitrosothiolen is nitrosylering van geoxideerde thiolen (NO reageren met een geoxideerd thiol):
RS• + NO → RS-NO
Dit mechanisme en de directe thioloxidatie met NO2 zouden alleen mogelijk kunnen zijn in zeer specifieke omstandigheden die elders worden beschreven21. S-nitrosothiolen variëren van lichte moleculen zoals S-nitrosoglutathione tot grote thiolbevattende eiwitten. S-nitrosohemoglobine (S-NO-Hb) wordt gevormd door nitrosatie van een thiolgroep van een geconserveerd cysteïneresidu in de β-keten (β93C)22.
De generatie en het metabolisme van S-nitrosothiolen maken deel uit van belangrijke regulerende mechanismen. Voorbeelden hiervan zijn regulatie van glutathion, caspasen, N-methyl-D-Aspartaat (NMDA) en ryanodinereceptoren 23,24,25,26,27,28. Eerder beschouwd als een belangrijke mediator van NO-biologie in vivo, lijkt nitrosated albumine (S-nitroso-albumine) een NO / NO + transporter te zijn zonder enige specifieke extra biologische activiteit29.
Bij het meten van de concentratie van NO en zijn derivaten van een specifiek biologisch monster binnen een biologische matrix, is het belangrijk om rekening te houden met kenmerken zoals zuurgraad, oxygenatie, temperatuur en de aanwezigheid van reagentia. Voorbeelden hiervan zijn toegediende exogene NO-donoren en, in de setting van acute ontsteking, waterstofperoxide (H2O2) dat reageert met NO2 , wat leidt tot het genereren van supernormale concentratie van vrije radicalen zoals peroxynitriet (ONOO–)21. Naast de analysemethode die wordt gebruikt, is de preanalytische fase van monstervoorbereiding en -opslag van fundamenteel belang. Stroomafwaartse reacties die niet de in vivo NO-activiteit vertegenwoordigen, moeten worden voorspeld, overwogen en geblokkeerd. Een geldig voorbeeld is de instabiliteit van S-NO-Hb, die een speciale behandeling van bloedmonsters vereist wanneer deze is gericht op meting22.
Chemiluminescentie-gebaseerde assays zijn de gouden standaard voor het detecteren van de niveaus van NO en zijn belangrijkste metabolieten [NO2–, NO3–, S-NO en ijzer-nitrosylcomplexen (Fe-NO)] in elke biologische vloeistof, inclusief weefselhomogenaten30,31. Deze methoden zijn gebaseerd op de chemiluminescentiedetector (CLD), een apparaat dat de reactie van NO met ozon (O3) herbergt en NO2 genereert in een aangeslagen toestand (NO2•). Relaxatie van NO2• veroorzaakt emissie van een foton van licht dat wordt gedetecteerd door een fotomultiplicatorbuis, waardoor een elektrisch signaal wordt gegenereerd dat recht evenredig is met het NO-gehalte van het bemonsterde gasmengsel32. Een vereenvoudigd schema van de CLD wordt weergegeven.
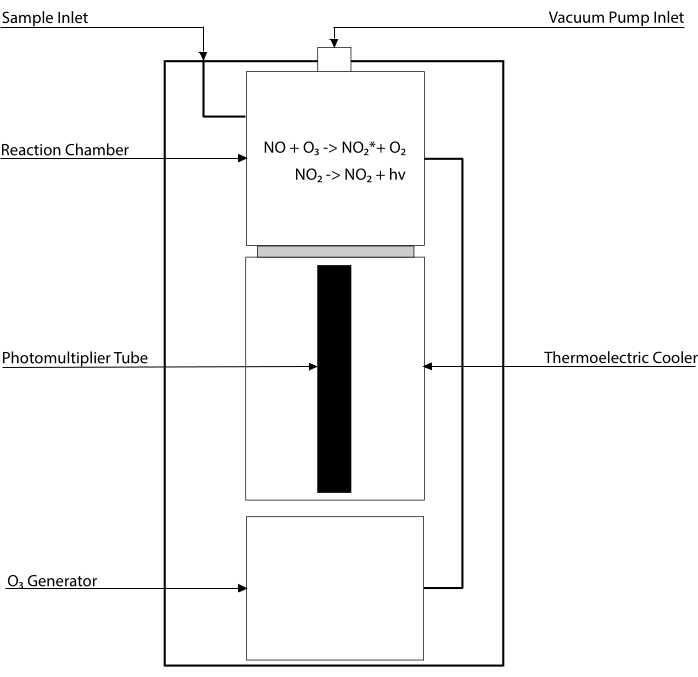
Figuur 1: Vereenvoudigd schema van een chemiluminescentiedetector voor stikstofmonoxidegas. Chemiluminescentie-gebaseerde detectie van stikstofmonoxide (NO) is de stoichiometrische generatie van één foton per NO-gasmolecuul die wordt geïntroduceerd in de chemiluminescentiedetector (CLD). De chemiluminescentiereactie wordt verkregen in een aangewezen kamer die wordt geleverd met ozon (O3) van een interne generator, die op negatieve druk wordt gehouden door verbinding met een externe pomp, waardoor een continue en constante instroom van monstergas mogelijk is. De generatie van O3 vereist diatomische zuurstof (O2) die wordt geleverd door een speciale O2-tank die is aangesloten op de CLD (andere fabrikanten leveren CLD’s die werken met omgevingslucht). In de reactiekamer reageert elk molecuul NO-gas in het bemonsterde gas met zuurstof om één molecuul stikstofdioxide in de geactiveerde toestand (NO2*) op te leveren. Door terug te keren naar zijn grondtoestand zendt elk NO2*-molecuul één foton uit dat wordt gedetecteerd door een fotomultiplicatorbuis (PMT) die zich naast de reactiekamer bevindt. De PMT met de bijbehorende versterker en centrale verwerkingseenheid produceert een signaal dat evenredig is met het aantal fotonen en het aantal NO-moleculen in de reactiekamer. Klik hier om een grotere versie van deze figuur te bekijken.
De monsterinlaat van de CLD kan worden aangesloten op een glaswerksysteem met een reactiekamer voor vloeistofmonsters. Het systeem wordt continu gezuiverd met een inert gas zoals stikstof, helium of argon, waardoor NO van de reactiekamer naar de CLD wordt overgebracht. Vloeistoffasemonsters worden via een speciaal membraan in het spoelvat geïnjecteerd.
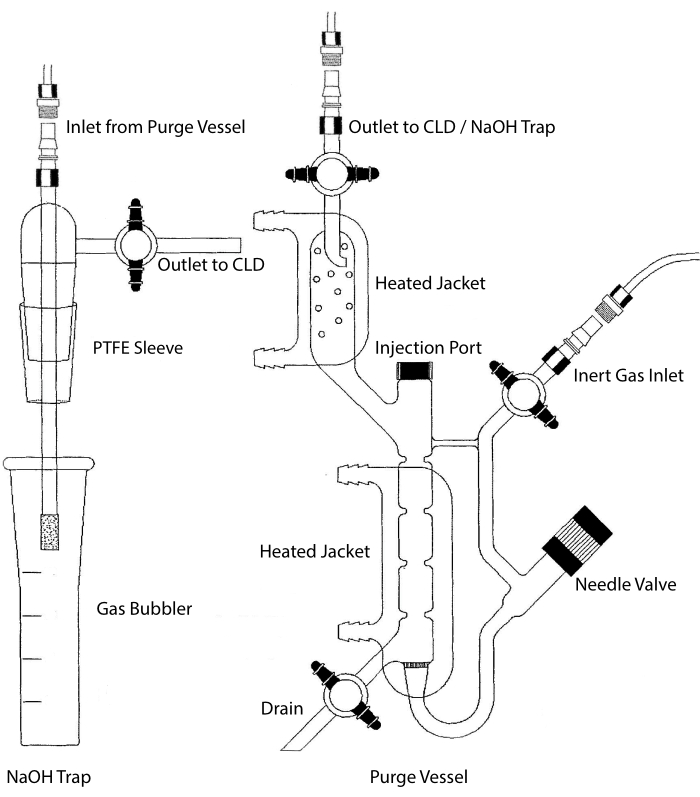
Figuur 2: Structuur van een zuiveringsvat voor op chemiluminescentie gebaseerde detectie van stikstofmonoxidegas Het spoelvat (rechts) maakt de detectie van stikstofmonoxide (NO) gas of een andere verbinding mogelijk die gemakkelijk kan worden omgezet in NO-gas wanneer deze vrijkomt uit een vloeibaar fasereagens. De inerte gasinlaat is verbonden met een bron (tank) van een inert gas zoals Argon, Xeon of diatomische stikstof (N2). De naaldklep (opent aan de linkerkant) wordt gebruikt voor drukregeling in het spoelvat en kan volledig worden verwijderd om het vat te reinigen. De injectiepoort wordt afgedekt door een dop met een membraantussenschot voor monsterinjectie. Het membraan moet vaak worden vervangen. Een verwarmde mantel omringt de reactiekamer en is aangesloten op een warmwaterbad om de VCl3 in HCl-assay uit te voeren. De afvoer van het spoelvat is aangesloten op de chemiluminescentiedetector (CLD) of op de NaOH-val (vereist voor VCl3 in HCl-assays). Om de inhoud van de reactiekamer af te tappen, sluit u eerst de stopkranen bij de inerte gasinlaat en de afvoer van het spoelvat, sluit u de naaldklep, verwijdert u de dop bij de injectiepoort en opent u ten slotte de stopkraan bij de afvoer. De NaOH-val (links) moet in lijn tussen het spoelvat en de CLD worden geplaatst als de VCl3 in HCl-test wordt uitgevoerd vanwege de corrosie van HCl. De verbinding met de CLD vereist altijd dat een intens veld diëlektrisch (IFD) filter wordt geplaatst tussen de CLD en de uitgang van het spoelvat (of de NaOH-val, indien gebruikt). Het IFD-filter verwijdert deeltjes in de lucht en voorkomt dat vloeistof door het spoelvat gaat. PTFE = polytetrafluorethyleen. Klik hier om een grotere versie van deze figuur te bekijken.
Als gevolg hiervan kan elke verbinding die door een specifieke en gecontroleerde chemische reactie in NO kan worden omgezet, met hoge gevoeligheid worden gedetecteerd in elke biologische vloeistof en weefselhomogenaat24. Directe meting van gasfase NO door chemiluminescentie wordt uitgevoerd in zowel experimentele als klinische omgevingen. Deze technieken worden elders uitgebreid beschreven 33,34,35. Meting van NO2–, S-nitrosothiolen, S-nitrosated eiwitten en Fe-NOs kan worden uitgevoerd door monsters toe te voegen in een reactiemengsel met triiodide (I3–), dat stoichiometrisch GEEN gas vrijgeeft uit al deze verbindingen:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
terwijl ik3– niet reageert met NO 3-15. Nauwkeurige metingen van elke verbinding worden mogelijk gemaakt door voorbehandeling van monsters met aangezuurd sulfanilamide (AS) met of zonder kwikchloride (HgCl2). In het bijzonder verwijdert de voorbehandeling met AS alle NO 2-inhoud. Als gevolg hiervan weerspiegelt het NO-gehalte gemeten door de CLD alleen de som van de concentratie van S-NOs en Fe-NOs. Injectie van HgCl2 in een monster aliquot vóór AS-injectie zorgt ervoor dat NO2– wordt vrijgegeven door S-NO. Behandeling met AS (leidend tot NO 2-verwijdering) zorgt ervoor dat het gemeten NO-gehalte alleen de concentratie van Fe-NOs weerspiegelt. Een reeks aftrekkingen tussen de beoordelingen maakt het mogelijk om de precieze concentratie van de drie NO-derivaten te berekenen22.
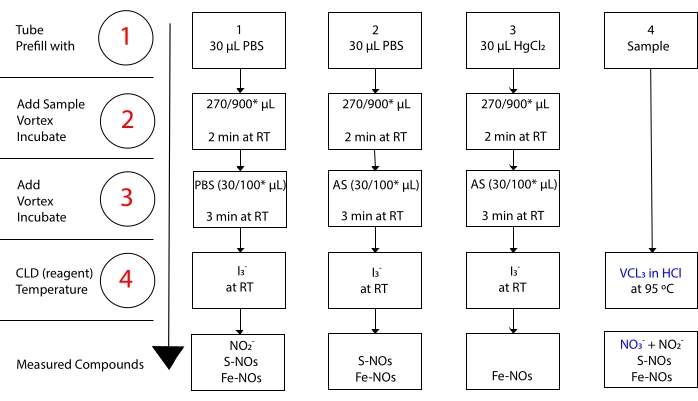
Figuur 3: Stappen in monstervoorbereiding voor de I3– in azijnzuur chemiluminescentietest. De opeenvolgende stappen voor de bereiding van de I3– in azijnzuur chemiluminescentietest worden geïllustreerd. Het gebruik van lichtbeveiligde centrifugebuizen is vereist. De buizen 1, 2 en 3 worden gebruikt om de test voor te bereiden. Een ander monster aliquot (buis 4) is nodig voor de VCl3 in HCl-test als de meting van nitraat (NO3–) vereist is. Stappen worden aangegeven met cijfers in het rood. Voorvullen (stap 1) zoals aangegeven met fosfaatbufferzoutoplossing (PBS) of HgCl2 voordat het monstervolume wordt toegevoegd. Voeg het monstervolume (2) toe zoals aangegeven, vortex, en incubeer gedurende 2 minuten bij kamertemperatuur (RT). Voeg (3) PBS of aangezuurd sulfanilamide (AS) toe zoals aangegeven, vortex en incubeer gedurende 3 minuten bij RT. Voer de test uit (4). De concentratie gemeten met de test is de som van de concentratie van de verbindingen die onder elke buis worden gerapporteerd. Buis nummer 1 maakt metingen van nitriet (NO2–), S-nitrosothiolen (S-NO) en ijzer-nitrosylcomplexen (Fe-NOs) als één signaal mogelijk. Voor nitraatmetingen (NO3-) moeten monsters worden uitgevoerd met zowel I3– in azijnzuur als VCl3 in HCl-assays, en de waarde verkregen uit buis 1 moet worden afgetrokken van die verkregen uit buis 4. *voorgestelde hoeveelheden die moeten worden gebruikt voor Hb-analyse voor de bepaling van restnummer2–, S-nitrosohemoglobine en ijzer-nitrosyl-hemoglobine. Klik hier om een grotere versie van deze figuur te bekijken.
Voor NO 3-meting wordt Vanadium (III) chloride (VCl3) in zoutzuur (HCl) gebruikt voor de omzetting van NO3– in NO in het spoelvat om NO3– stoichiometrisch te meten met de CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Om een voldoende snelle omzetting te bereiken, moet de reactie worden uitgevoerd bij 90-95 °C. Reductie van NO3– naar NO2– gaat gepaard met reductie van NO2– naar NO door HCl. Vanadiummetaal vermindert ook S-NOs waardoor hun NO-deelwordt bevrijd 22,36. De eindconcentratie verkregen door CLD met VCl3 in HCl weerspiegelt de totale concentratie van NO3–, NO2 en andere nitrosaatverbindingen. Aftrekking van deze laatste waarde van de met CLD met I3– opgewekte concentratie maakt het mogelijk om NO3– concentratie36,37 te berekenen (figuur 3).
In de NO-consumptietest genereert de continue afgifte van NO in het spoelvat door NO-donoren zoals (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolaat (DETA-NONOaat) een stabiel signaal waardoor celvrije oxyHb in de geïnjecteerde monsters kan worden gekwantificeerd. De hoeveelheid NO die in het zuiveringsvat wordt verbruikt, staat in een stoichiometrische relatie met de hoeveelheid oxyHb in het monster38.
Protocollen voor het meten van NO2–, NO3–, S-nitrosothiolen, ijzer-nitrosylcomplexen en NO-consumptie door celvrij Hb in plasmamonsters worden geïllustreerd. Studies naar NO in de RBC-omgeving vereisen een specifieke monsterbehandeling gevolgd door exclusiechromatografie om extreem fragiele S-NO-Hb en Hb-NO te meten in combinatie met de bepaling van de totale Hb-concentratie15,22. Monstervoorbereiding is instrumenteel bij het corrigeren van metingen. Het pre-bestaan van NO2– in H2O en het vrijkomen van NO2– tijdens de test kan leiden tot meting van kunstmatig hogere concentraties NO-derivaten zoals S-NO-Hb14,39. Belangrijke aspecten van monstervoorbereiding worden ook gepresenteerd.
Protocol
Representative Results
Discussion
Vanwege de hoge gevoeligheid hebben op chemiluminescentie gebaseerde assays voor de bepaling van NO en gerelateerde verbindingen een hoog risico op NO 2-contaminatie. Elk reagens (met name de NO2-blokkerende oplossing) en verdunningsmiddel (inclusief ddH2O) dat in het experiment wordt gebruikt, moet worden getest op zijn NO 2-gehalte om te corrigeren voor achtergrondsignaal. Nitriet is extreem reactief met een halfwaardetijd in volbloed rond de …
Disclosures
The authors have nothing to disclose.
Acknowledgements
De protocollen die in dit manuscript worden gerapporteerd, werden mogelijk gemaakt door de verzamelde bijdragen van eerdere fellows van Dr. Warren Zapol’s laboratorium voor anesthesieonderzoek in kritieke zorg, afdeling anesthesie in het Massachusetts General Hospital. We erkennen de bijdrage van Drs. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli en Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

