Хемилюминесцентные анализы для обнаружения оксида азота и его производных от аутоксидации и нитрозированных соединений
Summary
Здесь мы представляем протоколы обнаружения оксида азота и его биологически значимых производных с использованием хемилюминесцентных анализов с высокой чувствительностью.
Abstract
Активность оксида азота (NO) in vivo представляет собой комбинированные результаты его прямых эффектов, действия его производных, полученных в результате аутоксидации NO, и эффектов нитрозированных соединений. Измерение метаболитов NO имеет важное значение для изучения активности NO как на сосудистом уровне, так и в других тканях, особенно в экспериментальных условиях, где вводят экзогенный NO. Хемилюминесцентные анализы на основе озона позволяют точно измерять метаболиты NO и NO как в жидкостях (включая плазму, гомогенаты тканей, клеточные культуры), так и в газовых смесях (например, выдыхаемое дыхание). NO реагирует с озоном с образованием диоксида азота в возбужденном состоянии. Последующее световое излучение позволяет фотодетектировать и генерировать электрический сигнал, отражающий содержание NO в образце. Аликвоты из одного и того же образца могут быть использованы для измерения конкретных метаболитов NO, таких как нитраты, нитриты, S-нитрозотиолы и комплексы железа-нитрозила. Кроме того, NO, потребляемое бесклеточным гемоглобином, также количественно определяется с помощью хемилюминесцентного анализа. Приведена иллюстрация всех этих методов.
Introduction
С тех пор, как Сальвадор Монкада и нобелевские лауреаты Роберт Фурчготт, Луи Игнарро и Ферид Мурад определили оксид азота (NO) как ранее известный эндотелиальный фактор релаксации (EDRF), центральная роль NO была установлена в нескольких ключевых механизмах, охватывающих всю сосудистую биологию, нейронауки, метаболизм и реакцию хозяина 1,2,3,4,5,6,7 . Экзогенное введение газа NO стало устоявшимся методом лечения дыхательной недостаточности из-за легочной гипертензии у новорожденного8. Газ оксида азота также исследовался для лечения респираторно-синцитиальной вирусной (РСВ) инфекции, малярии и других инфекционных заболеваний, ишемии-реперфузионного повреждения, а также для профилактики острого повреждения почек у пациентов, перенесших кардиохирургию 9,10,11,12. Потребность в точных методах измерения для оценки уровней NO, его метаболитов и его целевых белков и соединений возникает как в результате механистических, так и интервенционных исследований.
Из-за своей высокой реакционной способности NO может подвергаться различным реакциям в зависимости от биологической матрицы, в которой он производится и/или высвобождается. При отсутствии гемоглобина (Hb) или других оксигемопротеинов NO окисляется почти полностью до нитритов (NO2–).
2NO + O2 → 2NO2
НЕТ2 + НЕТ → N2O3
N2O3 + H2O → NO2– + H+
NO сначала подвергается аутоксидации молекулярным кислородом (O2) с образованием диоксида азота (NO2) и реагирует с самим NO2 с образованием триоксида диазогена (N2O3). Одна молекулаN2O3 реагирует с водой (H2O) с образованием двух молекул NO2– и протона (H+)13. В цельной крови14,15 NO и NO2– быстро превращаются в нитрат (NO3–), поскольку эти молекулы жадно реагируют с окисленными гемовыми группами Hb [Hb-Fe2+-O2 или оксигемоглобин (oxyHb)] с образованием NO3–. Эта реакция сочетается с переходом гемовой группы в железосодержащее состояние [Hb-Fe3+ или метгемоглобин (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
Барьер эритроцитов (ЭРИАК) и пространство, непосредственно прилегающее к эндотелию, являются основными факторами, ограничивающими эту реакцию и позволяющими небольшой части NO, высвобождаемого эндотелием, действовать как EDRF16,17. Фактически, бесклеточный Hb в циркуляции, как известно, нарушает вазодилатацию в экспериментальных и клинических условиях17,18. В эритроцитах, в зависимости от оксигенации и концентрации NO2-, часть NO реагирует с дезоксигемоглобином (Hb-Fe2+) с образованием железа-нитрозила Hb (Hb-Fe2+-NO или HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
В RBC15,17 NO2– может образовывать Hb-Fe3+ путем снижения Hb-Fe2+, что приводит к высвобождению NO, что, в свою очередь, связывает Hb-Fe2+-O2 (предпочтительно) или Hb-Fe2+.
Генерацию NO-производных не следует считать строго однонаправленной, поскольку NO может быть регенерирован из NO2– и NO3– в различных тканях и различными ферментами (например, кишечными бактериями или в митохондриях, особенно в гипоксических условиях)19,20.
Переменное количество NO, продуцируемого (или вводимого) приводит к последующей генерации S-нитрозотиолов, главным образом путем транснитрозации тиола изN2O3 в присутствии нуклеофила, создающего донорский промежуточный продукт NO+ (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
Другой возможностью генерации S-нитрозотиол является нитрозилирование окисленных тиолов (NO, реагирующих с окисленным тиолом):
RS• + НЕТ → RS-NO
Этот механизм и прямое окисление тиола NO2 могут быть возможны только в очень специфических условиях, которые описаны в другом месте21. S-нитрозотиолы варьируются от легких молекул, таких как S-нитрозоглутатион, до крупных тиолсодержащих белков. S-нитрозогемоглобин (S-NO-Hb) образуется путем нитрозации тиольной группы консервированного цистеинового остатка в β цепи (β93C)22.
Генерация и метаболизм S-нитрозотиолов являются частью важных регуляторных механизмов. Примеры включают регуляцию глутатиона, каспаз, N-метил-D-аспартата (NMDA) и рианодиновых рецепторов 23,24,25,26,27,28. Ранее считавшийся основным медиатором биологии NO in vivo, нитрозированный альбумин (S-нитрозо-альбумин), по-видимому, является переносчиком NO/NO+ без какой-либо конкретной дополнительной биологической активности29.
При измерении концентрации NO и его производных из конкретного биологического образца в биологической матрице важно учитывать такие характеристики, как кислотность, оксигенация, температура и наличие реагентов. Примеры включают вводимые экзогенные доноры NO и, в условиях острого воспаления, перекись водорода (H2O2), реагирующую с NO2 , приводящую к образованию сверхнормальной концентрации свободных радикалов, таких как пероксинитрит (ONOO–)21. В дополнение к используемому аналитическому методу, предварительный аналитический этап подготовки и хранения образцов является основополагающим. Последующие реакции, которые не представляют активность IN vivo NO, должны прогнозироваться, учитываться и блокироваться. Достоверным примером является нестабильность S-NO-Hb, требующая специальной обработки образцов крови, когда она нацелена на измерение22.
Анализы на основе хемилюминесценции являются золотым стандартом для обнаружения уровней NO и его основных метаболитов [NO2–, NO3–, S-NO и железо-нитрозиловых комплексов (Fe-NO)] в любой биологической жидкости, включая тканевые гомогенаты30,31. Эти методы основаны на детекторе хемилюминесценции (CLD), устройстве, в котором находится реакция NO с озоном (O3), генерируя NO2 в возбужденном состоянии (NO2•). Релаксация NO2• вызывает испускание фотона света, который обнаруживается трубкой фотоумножителя, генерируя электрический сигнал, прямо пропорциональный содержанию NO в отобранной газовой смеси32. Представлена упрощенная схема CLD.
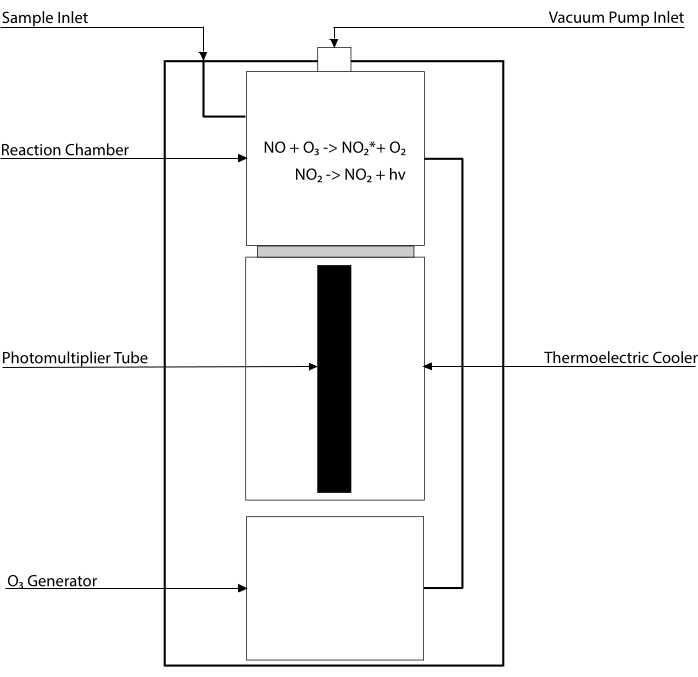
Рисунок 1: Упрощенная схема хемилюминесцентного детектора для газа оксида азота. Обнаружение оксида азота (NO) на основе хемилюминесценции представляет собой стехиометрическую генерацию одного фотона на молекулу газа NO, которая вводится в детектор хемилюминесценции (CLD). Реакцию хемилюминесценции получают в назначенной камере, снабжаемой озоном (О3) от внутреннего генератора, который поддерживается при отрицательном давлении путем соединения с внешним насосом, обеспечивая непрерывный и постоянный приток пробного газа. Для генерации O3 требуется двухатомный кислород (O2), который подается из специального резервуара O2 , подключенного к CLD (другие производители предоставляют CLD, работающие с окружающим воздухом). В реакционной камере каждая молекула газа NO, содержащаяся в отобранном газе, реагирует с кислородом с образованием одной молекулы диоксида азота в активированном состоянии (NO2*). Возвращаясь в основное состояние, каждая молекула NO2* испускает один фотон, который обнаруживается трубкой фотоумножителя (PMT), расположенной рядом с реакционной камерой. PMT с соответствующим усилителем и центральным процессором производит сигнал, пропорциональный количеству фотонов и количеству молекул NO в реакционной камере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Входное отверстие для образцов CLD может быть соединено со стеклянной системой, содержащей реакционную камеру для жидких образцов. Система непрерывно продувается инертным газом, таким как азот, гелий или аргон, перенося NO из реакционной камеры в CLD. Образцы жидкой фазы впрыскиваются через специальную мембрану в продувочный сосуд.
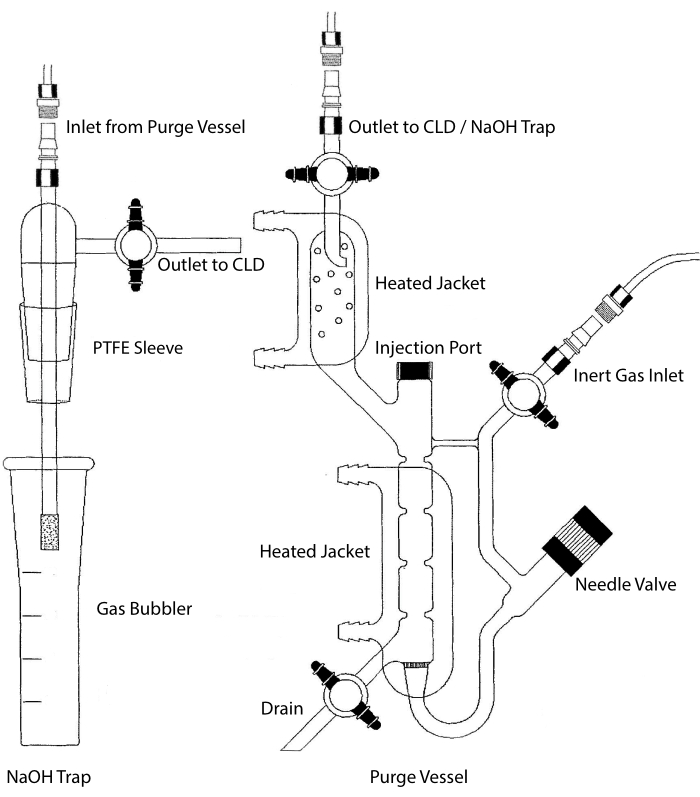
Рисунок 2: Структура продувочного сосуда для обнаружения на основе хемилюминесценции газа оксида азота Продувочный сосуд (справа) позволяет обнаруживать газ оксида азота (NO) или любое другое соединение, которое может быть легко преобразовано в газ NO при высвобождении из реагента жидкой фазы. Входное отверстие инертного газа соединено с источником (резервуаром) инертного газа, такого как аргон, ксеон или двухатомный азот (N2). Игольчатый клапан (открывается влево) используется для контроля давления в продувочном сосуде и может быть полностью удален для очистки сосуда. Инъекционный порт закрыт колпачком с мембранной перегородкой для инъекции образца. Мембрану следует часто заменять. Нагретая рубашка окружает реакционную камеру и подключается к бане с горячей водой для выполнения анализа VCl3 в HCl. Выходное отверстие продувочного сосуда подключается к хемилюминесцентному детектору (CLD) или к ловушке NaOH (требуется для VCl3 в анализах HCl). Чтобы слить содержимое реакционной камеры, сначала закройте запорные краны на входе инертного газа и выпускном отверстии продувочного сосуда, закройте игольчатый клапан, снимите колпачок в инжекторном отверстии и, наконец, откройте запорный кран в сливе. Ловушку NaOH (слева) необходимо разместить в линии между продувочным сосудом и CLD, если анализ VCl3 в HCl выполняется из-за коррозионной активности HCl. Для подключения к CLD всегда требуется диэлектрический фильтр интенсивного поля (IFD), который должен быть размещен между CLD и выходом продувочного сосуда (или ловушки NaOH, если используется). Фильтр IFD удаляет взвешенные в воздухе частицы и предотвращает прохождение жидкости через продувочный сосуд. PTFE = политетрафторэтилен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Как следствие, любое соединение, которое может быть преобразовано в NO посредством специфической и контролируемой химической реакции, может быть обнаружено с высокой чувствительностью в любой биологической жидкости и гомогенатеткани 24. Прямое измерение газовой фазы NO посредством хемилюминесценции проводится как в экспериментальных, так и в клинических условиях. Эти методы подробно описаны в других местах 33,34,35. Измерение NO2–, S-нитрозотиолов, S-нитрозированных белков и Fe-NOs может быть выполнено путем добавления образцов в реакционную смесь с трийодидом (I3–), который стехиометрически высвобождает газ NO из всех этих соединений:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
в то время как I3– не реагирует с NO 3-15. Точные измерения каждого соединения становятся возможными благодаря предварительной обработке образцов аликвот подкисленным сульфаниламидом (АС) с хлоридом ртути или без него (HgCl2). В частности, предварительная обработка AS удаляет все содержание NO 2. Как следствие, содержание NO, измеренное ЦБМ, отражает только сумму концентраций S-NOs и Fe-NOs. ИнъекцияHgCl2 в образец аликвоты перед инъекцией AS приводит к высвобождению NO2– S-NO. Обработка АС (приводящая к удалению NO2– гарантирует, что измеренное содержание NO отражает только концентрацию Fe-NOs. Ряд вычитаний между оценками позволяет рассчитать точную концентрацию трех производных NO22.
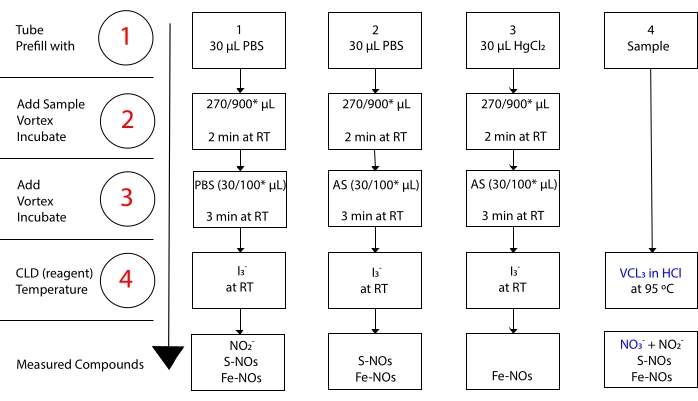
Рисунок 3: Этапы пробоподготовки для I3– в хемилюминесцентном анализе уксусной кислоты. Проиллюстрированы последовательные этапы приготовления I3– в хемилюминесцентном анализе уксусной кислоты. Требуется использование светонепроницаемых центрифужных трубок. Трубки 1, 2 и 3 используются для подготовки к анализу. Еще одна аликвота образца (пробирка 4) необходима для анализа VCl3 в HCl, если требуется измерение нитрата (NO3–). Шаги обозначены цифрами красным цветом. Предварительное заполнение (этап 1), как указано, фосфатным буферным физиологическим раствором (PBS) или HgCl2 перед добавлением объема образца. Добавьте объем образца (2), как указано, вихрь и инкубируйте в течение 2 мин при комнатной температуре (RT). Добавьте (3) PBS или подкисленный сульфаниламид (AS), как указано, вихрь, и инкубируйте в течение 3 мин на RT. Запустите анализ (4). Концентрация, измеренная с помощью анализа, представляет собой сумму концентрации соединений, указанных под каждой пробиркой. Трубка No1 позволит измерять нитриты (NO2–), S-нитрозотиолы (S-NO) и комплексы железа-нитрозила (Fe-NOs) в качестве единого сигнала. Для измерения нитратов (NO3–) образцы обрабатываются с использованием как I3– в уксусной кислоте, так и VCl3 в анализах HCl, а значение, полученное из трубки 1, должно быть вычтено из значения, полученного из трубки 4. *предлагаемые количества, которые будут использоваться для анализа Hb для определения остаточного NO2–, S-нитрозогемоглобина и железо-нитрозил-гемоглобина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для измерения NO3– хлорид ванадия (III) (VCl3) в соляной кислоте (HCl) используется для преобразования NO3– в NO в продувочном сосуде с целью измерения NO3– стехиометрически с помощью CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Для достижения достаточно быстрого преобразования реакцию необходимо проводить при 90-95 °C. Восстановление с NO3– до NO2– сочетается с восстановлением NO2– до NO HCl. Металл ванадия также уменьшает S-NOs, высвобождая их NO часть22,36. Конечная концентрация, полученная с помощью CLD с VCl3 в HCl, отражает совокупную концентрацию NO3–, NO2 и других нитрозированных соединений. Вычитание последнего значения из концентрации, полученной с помощью CLD с I3– позволяет рассчитать концентрацию NO3– 36,37 (рисунок 3).
В анализе потребления NO непрерывное высвобождение NO в продувочном сосуде донорами NO, такими как (Z)-1-[2-(2-аминоэтил)-N-(2-аммониоэтил)амино]диазен-1-иум-1,2-диолат (DETA-NONOate), генерирует стабильный сигнал, позволяющий количественно определять бесклеточный oxyHb в введенных образцах. Количество NO, потребляемого в продувочном сосуде, находится в стехиометрической зависимости от количества оксиHb в образце38.
Проиллюстрированы протоколы измерения потребления NO2–, NO3–, S-нитрозотиолов, железо-нитрозиловых комплексов и NO бесклеточным Hb в образцах плазмы. Исследования NO в среде эритроцитов требуют специальной обработки образца с последующей эксклюзионной хроматографией для измерения чрезвычайно хрупких S-NO-Hb и Hb-NO в сочетании с определением общей концентрации Hb15,22. Пробоподготовка играет важную роль в коррекции измерений. Предварительное существование NO2– вH2Oи высвобождение NO2– во время анализа может привести к измерению искусственно более высоких концентраций производных NO, таких как S-NO-Hb14,39. Также представлены важные аспекты пробоподготовки.
Protocol
Representative Results
Discussion
Из-за высокой чувствительности хемилюминесцентные анализы для определения NO и связанных с ним соединений имеют высокий риск загрязнения NO2–. Каждый реагент (особенно NO 2-блокирующий раствор) и разбавитель (включая ddH2O), используемые в эксперименте, должны бы…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Протоколы, описанные в этой рукописи, стали возможными благодаря накопленному вкладу предыдущих сотрудников лаборатории исследований анестезии в реаниматологии доктора Уоррена Запола, отделение анестезии в Массачусетской больнице общего профиля. Мы признаем вклад докторов Акито Накагавы, Франческо Задека, Эмануэле Вассены, Чонг Лея, Ясуко Нагасака, Эстер Спаньолли и Эмануэле Резоальи.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

