自動酸化およびニトロソ化化合物からの一酸化窒素およびその誘導体の検出のための化学発光ベースのアッセイ
Summary
ここでは、化学発光ベースのアッセイを高感度に使用して、一酸化窒素およびその生物学的に関連する誘導体を検出するためのプロトコルを提示する。
Abstract
インビボにおける一酸化窒素(NO)活性は、その直接的な効果、NO自己酸化から生成されるその誘導体の作用、およびニトロソ化化合物の効果を組み合わせた結果である。NO代謝産物の測定は、血管レベルおよび他の組織の両方で、特に外因性NOが投与される実験環境において、NO活性を研究するために不可欠である。オゾンベースの化学発光アッセイは、体液(血漿、組織ホモジネート、細胞培養物を含む)および混合ガス(呼気など)の両方におけるNOおよびNO代謝産物の正確な測定を可能にします。NOはオゾンと反応して励起状態で二酸化窒素を発生する。結果として生じる発光は、光検出および試料のNO含有量を反映する電気信号の発生を可能にする。同じサンプルからのアリコートを使用して、硝酸塩、亜硝酸塩、S-ニトロソチオール、鉄-ニトロシル錯体などの特定のNO代謝産物を測定することができます。また、無細胞ヘモグロビンによって消費されるNOも化学発光分析により定量される。これらすべての手法の図を示します。
Introduction
サルバドール・モンカダとノーベル賞受賞者のロバート・フルチゴット、ルイ・イグナロ、フェリド・ムラドが一酸化窒素(NO)を以前に知られていた内皮由来の緩和因子(EDRF)として同定して以来、NOの中心的な役割は、血管生物学、神経科学、代謝、および宿主応答全体にわたるいくつかの重要なメカニズムにおいて確立されている1,2,3,4,5,6,7。.NOガスの外因性投与は、新生児8における肺高血圧症による呼吸不全に対する確立された治療法となっている。一酸化窒素ガスはまた、呼吸器合胞体ウイルス(RSV)感染、マラリアおよび他の感染性疾患、虚血再灌流傷害の治療、および心臓手術を受けている患者の急性腎障害の予防のために研究されている9、10、11、12。NO、その代謝産物、およびその標的タンパク質および化合物のレベルを評価するための正確な測定技術の必要性は、機構的および介入的研究の両方から生じる。
その高い反応性のために、NOは、それが産生および/または放出される生物学的マトリックスに応じて異なる反応を受け得る。ヘモグロビン(Hb)または他のオキシヘモタンパク質の非存在下では、NOはほぼ完全に亜硝酸塩(NO2−)に酸化される。
2NO + O 2 → 2NO2
NO 2 + NO → N2O3
N 2 O3 + H 2 O →NO2– + H+
NOは、まず分子状酸素(O2)による自動酸化を受けて二酸化窒素(NO2)を生成し、NO2自体と反応して三酸化二窒素(N2O3)を生成する。N2O3の1分子は水(H2O)と反応してNO2–とプロトン(H+)13の2分子を形成する。全血14、15内では、これらの分子がHb[Hb-Fe2+-O2またはオキシヘモグロビン(oxyHb)]の酸化ヘム基と激しく反応してNO3-を生成するため、NOおよびNO2–は硝酸塩(NO3–)に急速に変換される。この反応は、ヘム基の第二鉄状態[Hb-Fe3+またはメト化物(metHb)]への遷移と結合している:
Hb-Fe2+–O2 + NO→ Hb-Fe3++NO3–
赤血球(RBC)関門および内皮のすぐ隣の空間は、この反応を制限する主な要因であり、内皮によって放出されるNOのごく一部がEDRF16,17として作用することを可能にする。実際、循環中の無細胞Hbは、実験的および臨床的設定において血管拡張を破壊することが知られている17、18。RBC内では、酸素化およびNO2-濃度に応じて、NOの一部がデオキシヘモグロビン(Hb-Fe2+)と反応して鉄ニトロシルHb(Hb-Fe2+-NOまたはHbNO)を形成する:
Hb-Fe2+ + NO → Hb-Fe2+-NO
RBC15,17において、NO2−は、NOの放出につながるHb−Fe2+を減少させることによってHb−Fe3+を形成することができ、これは次にHb−Fe2+−O2(優先的に)またはHb−Fe2+と結合する。
NO誘導体の生成は、NOが様々な組織および異なる酵素(例えば、腸内細菌またはミトコンドリア内、特に低酸素条件下で)によってNO2−およびNO3−から再生され得るので、厳密に一方向であると考えるべきではない19,20。
産生(または投与)される可変量のNOは、主に求核剤の存在下でのN2O3からのチオールトランスニトロソ化によって、S-ニトロソチオールの下流生成をもたらし、NO+ドナー中間体(Nuc-NO+–NO2–)を生成する:
N 2 O3 + RS- → RS-NO + NO2–
S-ニトロソチオール生成の別の可能性は、酸化チオールのニトロシル化(酸化チオールと反応しない)である:
RS• + いいえ → RS-いいえ
この機構およびNO2 による直接チオール酸化は、他の場所21に記載されている非常に特定の条件においてのみ可能であり得る。S-ニトロソチオールは、S-ニトロソグルタチオンのような軽分子から大きなチオール含有タンパク質まで多岐にわたります。S−ニトロソヘモグロビン(S−NO−Hb)は、β鎖(β93C)22において保存されたシステイン残基のチオール基のニトロソ化によって形成される。
S-ニトロソチオールの生成および代謝は、重要な調節機構の一部である。例としては、グルタチオン、カスパーゼ、N−メチル−D−アスパラギン酸(NMDA)、およびリアノジン受容体23、24、25、26、27、28の調節が挙げられる。以前はインビボでのNO生物学の主要なメディエーターと考えられていたニトロソ化アルブミン(S-ニトロソアルブミン)は、特定の追加の生物学的活性を伴わないNO/NO+トランスポーターであるようである29。
生体マトリックス中の特定の生体試料からのNOおよびその誘導体の濃度を測定する場合、酸性度、酸素化、温度、試薬の存在などの特性を考慮することが重要です。例としては、投与された外因性NOドナー、および、急性炎症の設定において、過酸化水素(H2O2)がNO2と反応して、ペルオキシ亜硝酸塩(ONOO)21のような超常的な濃度のフリーラジカルの生成をもたらす。採用されている分析方法に加えて、サンプル調製および保管の前分析段階が基本です。インビボNO活性を表さない下流反応は、予測され、考慮され、遮断されなければならない。有効な例は、S−NO−Hbの不安定性であり、測定22の対象とされる場合、血液試料の専用治療を必要とする。
化学発光ベースのアッセイは、組織ホモジネート30、31を含む任意の生体液中のNOおよびその主要代謝産物[NO2-、NO3–、S-NOおよび鉄–ニトロシル錯体(Fe-NO)]のレベルを検出するためのゴールドスタンダードである。これらの方法は、NOとオゾン(O3)との反応を収容する装置である化学発光検出器(CLD)に依存し、励起状態でNO2を生成する(NO2•)。NO2•の緩和は、光電子増倍管によって検出される光の光子の放出を引き起こし、サンプリングされた混合ガス32のNO含有量に正比例する電気信号を生成する。CLDの簡略化された回路図が表されている。
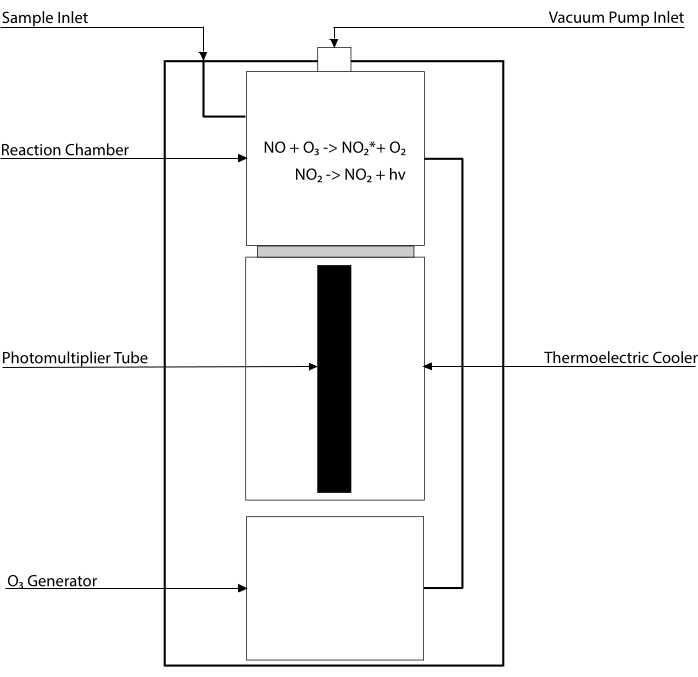
図1:一酸化窒素ガスの化学発光検出器の簡略回路図。化学発光ベースの一酸化窒素(NO)検出は、化学発光検出器(CLD)に導入されるNOガス分子あたり1つの光子の化学量論的生成である。化学発光反応は、内部発電機からオゾン(O3)を供給された指定チャンバ内で得られ、外部ポンプとの接続により負圧に保たれ、サンプルガスの連続的かつ一定の流入を可能にする。O3の生成には、CLDに接続された専用のO2タンクによって供給される二原子酸素(O2)が必要である(他の製造業者は周囲空気で動作するCLDを提供している)。反応室内では、サンプリングしたガスに含まれるNOガスの各分子が酸素と反応し、活性化状態の二酸化窒素(NO2*)が1分子生成します。基底状態に戻ることにより、各NO2*分子は、反応チャンバに隣接する光電子増倍管(PMT)によって検出される1つの光子を放出する。関連する増幅器および中央処理装置を備えたPMTは、反応チャンバ内の光子数およびNO分子の数に比例した信号を生成する。この図の拡大版を表示するには、ここをクリックしてください。
CLDのサンプル入口は、液体サンプル用の反応チャンバを含むガラス製品システムに接続することができる。システムは、窒素、ヘリウム、アルゴンなどの不活性ガスで連続的にパージされ、反応チャンバからCLDにNOが移送されます。液相サンプルは、専用のメンブレンを介してパージ容器に注入されます。
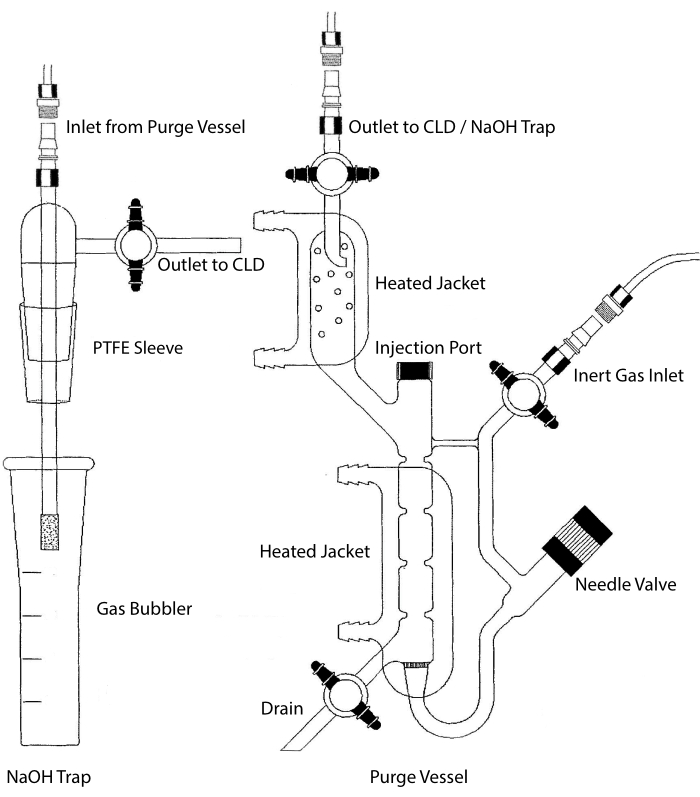
図2:化学発光に基づく一酸化窒素ガス検出のためのパージ容器の構造パージ容器(右)は、一酸化窒素(NO)ガスまたは液相試薬から放出されたときに容易にNOガスに変換できる他の任意の化合物の検出を可能にする。不活性ガス導入口は、アルゴン、キセオン、二原子窒素(N2)などの不活性ガスの供給源(タンク)に接続されています。ニードルバルブ(左に開きます)は、パージ容器内の圧力制御に使用され、容器を洗浄するために完全に取り外すことができます。注入口は、試料注入用の膜隔壁を備えたキャップで覆われている。膜は頻繁に交換する必要があります。加熱されたジャケットが反応チャンバを囲み、温水浴に接続され、HClアッセイにおいてVCl3を実行する。パージ容器出口は、化学発光検出器(CLD)またはNaOHトラップ(HClアッセイにおけるVCl3に必要)に接続されています。反応チャンバの内容物を排出するには、まず不活性ガス入口およびパージ容器出口の活栓を閉じ、ニードルバルブを閉じ、噴射口でキャップを取り外し、最後に排水口で活栓を開く。HClの腐食性のためにHClアッセイでVCl3が行われる場合、NaOHトラップ(左)はパージ容器とCLDの間にインラインで配置する必要があります。CLDへの接続には、CLDとパージ容器(または使用する場合はNaOHトラップ)の出力との間に、常に強磁界誘電体(IFD)フィルタを配置する必要があります。IFDフィルターは、浮遊粒子を除去し、液体がパージ容器を通過するのを防ぎます。PTFE = ポリテトラフルオロエチレン。この図の拡大版を表示するには、ここをクリックしてください。
結果として、特異的かつ制御された化学反応を介してNOに変換することができる任意の化合物は、任意の生物学的流体および組織ホモジネート24において高感度に検出され得る。化学発光による気相NOの直接測定は、実験的および臨床的環境の両方で行われます。これらの技術は、他の場所33、34、35で広範囲に説明されている。NO2-、S–ニトロソチオール、S-ニトロソ化タンパク質、およびFe-NOの測定は、三ヨウ化物(I3–)との反応混合物にサンプルを添加することによって行うことができ、これは化学量論的にこれらすべての化合物からNOガスを放出する:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I 2 +2H2 O
I 3− + 2RS-NO →3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO+ I2
I 3-はNO 3-15と反応しません。 各化合物の正確な測定は、塩化水銀(HgCl2)の有無にかかわらず、酸性化スルファニルアミド(AS)によるサンプルアリコートの前処理によって可能になります。具体的には、ASによる前処理は、すべてのNO2–コンテンツを除去する。結果として、CLDによって測定されたNO含有量は、S−NOおよびFe−NOs濃度の合計のみを反映する。AS注射前にサンプルアリコートにHgCl2を注入すると、S-NOによってNO2-が放出される。ASによる処理(NO2-除去につながる)は、測定されたNO含有量がFe-NOの濃度のみを反映することを確実にする。評価間の一連の減算は、3つのNO誘導体22の正確な濃度を計算することを可能にする。
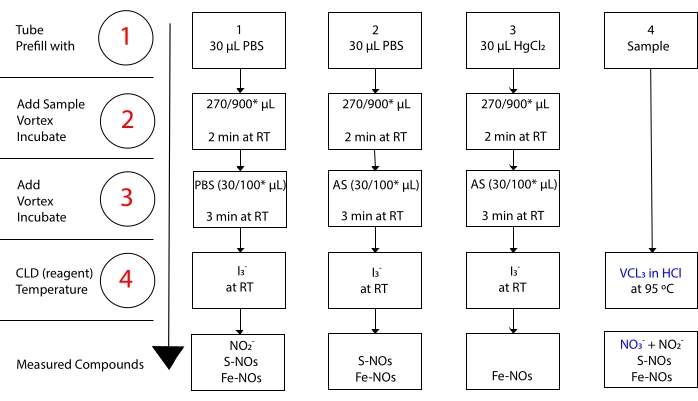
図3:I–酢酸化学発光アッセイのための試料調製における工程。I3–酢酸化学発光アッセイにおけるIを調製するための逐次的なステップが例示される。光保護された遠沈管を使用する必要があります。チューブ1、2、および3は、アッセイのために調製するために用いられるものである。硝酸塩(NO3–)の測定が必要な場合、HClアッセイにおけるVCl3のために別のサンプルアリコート(チューブ4)が必要である。手順は赤の数字で示されます。試料量を加える前に生理食塩水(PBS)またはHgCl2のリン酸緩衝液で示すようにプレフィル(ステップ1)。図示のとおりに試料量(2)を加え、渦、室温(RT)で2分間インキュベートした。(3)PBSまたは酸性化スルファニルアミド(AS)を指示どおりに添加し、渦巻き、RTで3分間インキュベートします。アッセイによって測定された濃度は、各チューブの下で報告された化合物の濃度の合計である。チューブ番号1は、亜硝酸塩(NO2-)、S-ニトロソチオール(S-NO)、および鉄-ニトロシル錯体(Fe-NO)を単一の信号として測定することを可能にする。硝酸塩(NO3–)測定の場合、サンプルは酢酸中のI3–およびHClアッセイ中のVCl3の両方を用いて実行されなければならず、チューブ1から得られた値はチューブ4から得られた値から差し引かれるべきである。 *残留NO2-、S-ニトロソヘモグロビンおよび鉄-ニトロシル–ヘモグロビンの測定のためのHb分析に使用する推奨量。この図の拡大版を表示するには、ここをクリックしてください。
NO3-測定の場合、塩酸(HCl)中の塩化バナジウム(III)(VCl3)は、CLDでNO3-を化学量論的に測定するために、パージ容器内のNO3–からNOへの変換に使用されます。
2 いいえ3–+ 3V + 3 + 2H 2 O →2NO+ 3VO2+ + 4H+
十分に速い変換を達成するためには、反応を90〜95°Cで行う必要がある。 NO3-からNO2–への還元は、HClによるNO2–からNOへの還元と結合される。HCl中のVCl3を用いてCLDにより得られた最終濃度は、NO3−、NO2、および他のニトロソ化化合物の凝集体濃度を反映する。I3-を有するCLDで得られた濃度から後者の値を差し引くと、NO3–濃度36、37の計算が可能になる(図3)。
NO消費アッセイでは、(Z)-1-[2-(2-アミノエチル)-N-(2-アンモニオエチル)アミノ]ジアゼン-1-イウム-1,2-ジオレート(DETA-NONOate)などのNOドナーによるパージ容器内のNOの連続放出は、注入されたサンプル中の無細胞オキシHbの定量を可能にする安定したシグナルを生成する。パージ容器内で消費されるNOの量は、試料38中のoxyHbの量と化学量論的関係にある。
血漿試料中のNO2−、NO3−、S−ニトロソチオール、鉄−ニトロシル錯体、および無細胞HbによるNO消費の測定のためのプロトコルが例示される。RBC環境におけるNOに関する研究では、非常に脆弱なS-NO-HbおよびHb-NOを測定するために、排除クロマトグラフィーに続く特定のサンプル処理と、総Hb濃度の測定(15、22)が必要です。サンプル調製は、測定の補正に役立ちます。アッセイ中のH2O中のNO2−の事前存在およびNO2−の放出は、S−NO−Hb14、39などの人為的に高濃度のNO誘導体の測定をもたらし得る。サンプル調製の重要な側面も提示する。
Protocol
Representative Results
Discussion
高感度のため、NOおよび関連化合物の測定のための化学発光ベースのアッセイは、NO2–汚染のリスクが高い。実験に使用した各試薬(特にNO2-ブロッキング溶液)および希釈剤(ddH2Oを含む)は、バックグラウンドシグナルを補正するためにそのNO2–含有量について試験されるべきである。亜硝酸塩は、全血中の半減期が約10分と非常に反応性が?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この原稿で報告されたプロトコルは、マサチューセッツ総合病院の麻酔科のクリティカルケアにおける麻酔研究のウォーレン・ザポール博士の研究室の以前のフェローの蓄積された貢献によって可能になりました。我々は、中川明人博士、フランチェスコ・ザデック博士、エマヌエーレ・ヴァッセナ博士、チョン・レイ博士、長坂靖子博士、エステル・スパニョッリ博士及びエマヌエーレ・レゾアグリ博士の貢献を認識する。
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

