Tests basés sur la chimiluminescence pour la détection de l’oxyde nitrique et de ses dérivés à partir de l’autoxidation et des composés nitrosés
Summary
Nous présentons ici des protocoles de détection de l’oxyde nitrique et de ses dérivés biologiquement pertinents à l’aide de tests basés sur la chimiluminescence avec une sensibilité élevée.
Abstract
L’activité de l’oxyde nitrique (NO) in vivo est le résultat combiné de ses effets directs, de l’action de ses dérivés générés par l’autoxidation du NO et des effets des composés nitrosés. La mesure des métabolites du NO est essentielle pour étudier l’activité du NO à la fois au niveau vasculaire et dans d’autres tissus, en particulier dans les milieux expérimentaux où le NO exogène est administré. Les tests de chimiluminescence à base d’ozone permettent de mesurer avec précision les métabolites du NO et du NO dans les fluides (y compris le plasma, les homogénats tissulaires, les cultures cellulaires) et les mélanges gazeux (p. ex., l’haleine expirée). Le NO réagit avec l’ozone pour générer du dioxyde d’azote dans un état excité. L’émission de lumière qui en résulte permet la photodétection et la génération d’un signal électrique reflétant la teneur en NO de l’échantillon. Les aliquotes du même échantillon peuvent être utilisées pour mesurer des métabolites spécifiques du NO, tels que le nitrate, le nitrite, les S-nitrosothiols et les complexes fer-nitrosyle. En outre, le NO consommé par l’hémoglobine sans cellules est également quantifié avec une analyse de chimiluminescence. Une illustration de toutes ces techniques est fournie.
Introduction
Depuis que Salvador Moncada et les lauréats du prix Nobel Robert Furchgott, Louis Ignarro et Ferid Murad ont identifié l’oxyde nitrique (NO) comme le facteur de relaxation dérivé de l’endothélium (EDRF) précédemment connu, le rôle central du NO a été établi dans plusieurs mécanismes clés couvrant la biologie vasculaire, les neurosciences, le métabolisme et la réponse de l’hôte 1,2,3,4,5,6,7 . L’administration exogène de gaz NO est devenue un traitement établi pour l’insuffisance respiratoire due à l’hypertension pulmonaire chez le nouveau-né8. Le gaz d’oxyde nitrique a également été étudié pour le traitement de l’infection par le virus respiratoire syncytial (VRS), du paludisme et d’autres maladies infectieuses, des lésions d’ischémie-reperfusion et pour la prévention des lésions rénales aiguës chez les patients subissant une chirurgie cardiaque 9,10,11,12. La nécessité de techniques de mesure précises pour évaluer les niveaux de NO, ses métabolites et ceux de ses protéines et composés cibles découle d’études mécanistes et interventionnelles.
En raison de sa forte réactivité, le NO peut subir des réactions différentes selon la matrice biologique dans laquelle il est produit et/ou libéré. En l’absence d’hémoglobine (Hb) ou d’autres oxy-hémoprotéines, le NO est oxydé presque complètement en nitrite (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2– + H+
Le NO subit d’abord une autoxidation avec de l’oxygène moléculaire (O2) pour produire du dioxyde d’azote (NO2) et réagit avec le NO2 lui-même pour générer du trioxyde de diazote (N2O3). Une molécule deN2O3réagit avec l’eau (H2O) pour former deux molécules de NO2– et un proton (H+)13. Dans le sang total14,15, le NO et le NO2– sont rapidement convertis en nitrate (NO3–) car ces molécules réagissent avidement avec les groupes hémiques oxydés de Hb [Hb-Fe2+–O2 ou oxyhémoglobine (oxyHb)] pour donner no3–. Cette réaction est couplée à la transition du groupe hème à l’état ferrique [Hb-Fe3+ ou méthémoglobine (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
La barrière des globules rouges (GR) et l’espace immédiatement adjacent à l’endothélium sont les principaux facteurs limitant cette réaction et permettant à une petite partie du NO libéré par l’endothélium d’agir comme EDRF16,17. En fait, l’Hb sans cellules dans la circulation est connue pour perturber la vasodilatation dans les contextes expérimentaux et cliniques17,18. Dans les globules rouges, en fonction de l’oxygénation et de la concentration de NO2,, une portion de NO réagit avec la désoxyhémoglobine (Hb-Fe2+) pour former du fer-nitrosyl Hb (Hb-Fe2+-NO ou HbNO) :
Hb-Fe2+ + NO → Hb-Fe2+-NO
Dans le RBC15,17, le NO 2– peut former de l’Hb-Fe3+ en réduisant l’Hb-Fe2+ conduisant à la libération de NO, qui à son tour lie Hb-Fe2+–O2 (préférentiellement) ou Hb-Fe2+.
La génération de dérivés du NO ne doit pas être considérée comme strictement unidirectionnelle, car le NO peut être régénéré à partir du NO2 et du NO3 dans divers tissus et par différentes enzymes (par exemple, par des bactéries intestinales ou dans les mitochondries, en particulier dans des conditions hypoxiques)19,20.
Une quantité variable de NO produite (ou administrée) conduit à la génération en aval de S-nitrosothiols, principalement par transnitrosation de thiol à partir deN2O3 en présence d’un nucléophile créant un intermédiaire donneur de NO+ (Nuc-NO+-NO2–) :
N2O3 + RS– → RS-NO + NO2–
Une autre possibilité pour la génération de S-nitrosothiols est la nitrosylation des thiols oxydés (NO réagissant avec un thiol oxydé):
RS• + PAS de → RS-NO
Ce mécanisme et l’oxydation directe du thiol par le NO2 pourraient n’être possibles que dans des conditions très spécifiques qui sont décrites ailleurs21. Les S-nitrosothiols vont des molécules légères comme le S-nitrosoglutathion aux grandes protéines contenant du thiol. La S-nitrosohémoglobine (S-NO-Hb) est formée par nitrosation d’un groupe thiol d’un résidu de cystéine conservé dans la chaîne β (β93C)22.
La génération et le métabolisme des S-nitrosothiols font partie d’importants mécanismes de régulation. Les exemples incluent la régulation du glutathion, des caspases, du N-méthyl-D-aspartate (NMDA) et des récepteurs de la ryanodine 23,24,25,26,27,28. Auparavant considérée comme un médiateur majeur de la biologie du NO in vivo, l’albumine nitrosée (S-nitroso-albumine) semble être un transporteur de NO/NO+ sans activité biologique supplémentaire spécifique29.
Lors de la mesure de la concentration de NO et de ses dérivés à partir d’un échantillon biologique spécifique dans une matrice biologique, il est important de prendre en compte des caractéristiques telles que l’acidité, l’oxygénation, la température et la présence de réactifs. Les exemples incluent les donneurs de NO exogènes administrés et, dans le cadre d’une inflammationaiguë, le peroxyde d’hydrogène (H2O 2) réagissant avec le NO2 conduisant à la génération d’une concentration surnormale de radicaux libres comme le peroxynitrite (ONOO–)21. En plus de la méthode analytique utilisée, la phase préanalytique de la préparation et du stockage des échantillons est fondamentale. Les réactions en aval qui ne représentent pas l’activité in vivo du NO doivent être prédites, prises en compte et bloquées. Un exemple valable est l’instabilité du S-NO-Hb, nécessitant un traitement dédié des échantillons de sang lorsqu’il est ciblé pour la mesure22.
Les tests basés sur la chimiluminescence sont la référence absolue pour détecter les niveaux de NO et de ses principaux métabolites [NO2–, NO3–, S-NO et complexes fer-nitrosyle (Fe-NO)] dans tout fluide biologique, y compris les homogénats tissulaires30,31. Ces méthodes s’appuient sur le détecteur de chimiluminescence (CLD), un dispositif qui abrite la réaction du NO avec l’ozone (O3), générant le NO2 à l’état excité (NO2•). La relaxation du NO2• provoque l’émission d’un photon de lumière détecté par un tube photomultiplicateur, générant un signal électrique directement proportionnel à la teneur en NO du mélange gazeux échantillonné32. Un schéma simplifié du CLD est représenté.
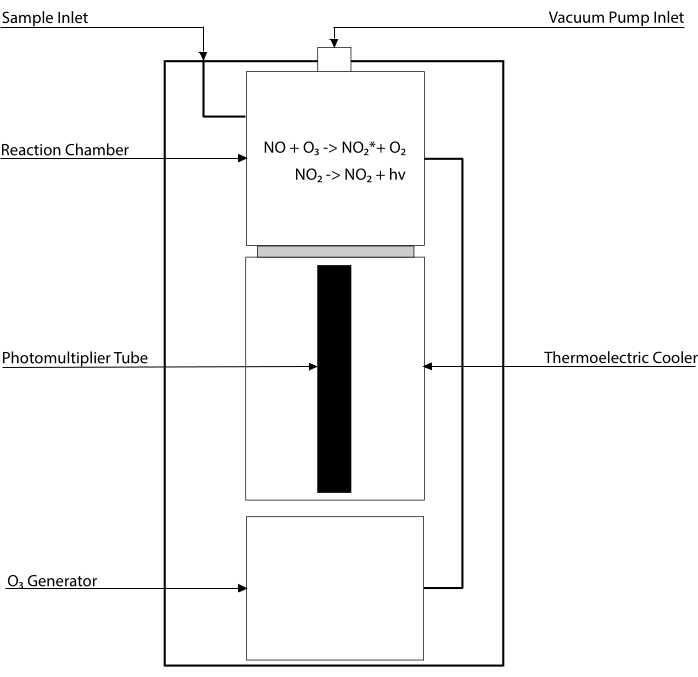
Figure 1 : Schéma simplifié d’un détecteur de chimiluminescence pour le gaz d’oxyde nitrique. La détection d’oxyde nitrique (NO) basée sur la chimiluminescence est la génération stœchiométrique d’un photon par molécule de gaz NO introduite dans le détecteur de chimiluminescence (CLD). La réaction de chimiluminescence est obtenue dans une chambre désignée alimentée en ozone (O3) à partir d’un générateur interne, qui est maintenu à pression négative par connexion avec une pompe externe, permettant un afflux continu et constant de gaz d’échantillonnage. La génération d’O3 nécessite de l’oxygène diatomique (O2) qui est alimenté par un réservoir O2 dédié connecté au CLD (d’autres fabricants fournissent des CLD fonctionnant avec de l’air ambiant). Dans la chambre de réaction, chaque molécule de GAZ NO contenue dans le gaz échantillonné réagit avec l’oxygène pour produire une molécule de dioxyde d’azote à l’état activé (NO2*). En revenant à son état fondamental, chaque molécule de NO2* émet un photon qui est détecté par un tube photomultiplicateur (PMT) situé à côté de la chambre de réaction. Le PMT avec l’amplificateur associé et l’unité centrale de traitement produit un signal proportionnel au nombre de photons et au nombre de molécules de NO dans la chambre de réaction. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’entrée d’échantillon du CLD peut être connectée à un système de verrerie contenant une chambre de réaction pour les échantillons liquides. Le système est continuellement purgé avec un gaz inerte tel que l’azote, l’hélium ou l’argon, transférant le NO de la chambre de réaction au CLD. Des échantillons en phase liquide sont injectés à travers une membrane dédiée dans le récipient de purge.
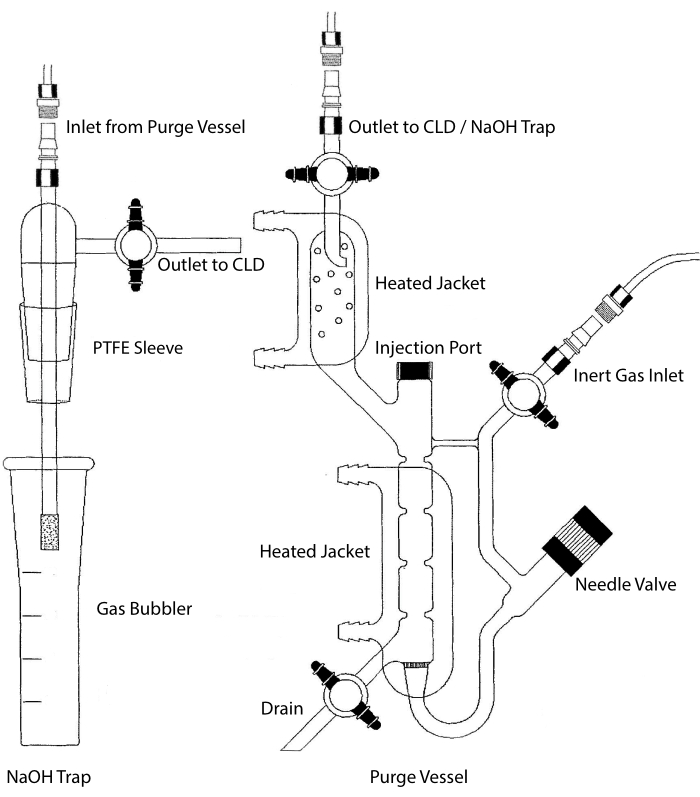
Figure 2 : Structure d’un récipient de purge pour la détection par chimiluminescence du gaz d’oxyde nitrique Le récipient de purge (à droite) permet la détection du gaz d’oxyde nitrique (NO) ou de tout autre composé qui peut être facilement converti en gaz NO lorsqu’il est libéré d’un réactif en phase liquide. L’entrée de gaz inerte est reliée à une source (réservoir) d’un gaz inerte tel que l’argon, le xeon ou l’azote diatomique (N2). La valve à aiguille (s’ouvre à gauche) est utilisée pour le contrôle de la pression dans le récipient de purge et peut être complètement retirée pour nettoyer le récipient. L’orifice d’injection est recouvert d’un capuchon avec un septum membranaire pour l’injection d’échantillons. La membrane doit être remplacée souvent. Une veste chauffante entoure la chambre de réaction et est reliée à un bain d’eau chaude pour effectuer le test VCl3 en HCl. La sortie du récipient de purge est connectée au détecteur de chimiluminescence (CLD) ou au piège NaOH (requis pour VCl3 dans les tests HCl). Pour drainer le contenu de la chambre de réaction, fermez d’abord les robinets d’arrêt à l’entrée de gaz inerte et à la sortie du récipient de purge, fermez la vanne à aiguille, retirez le bouchon à l’orifice d’injection et enfin ouvrez le robinet d’arrêt au niveau du drain. Le piège NaOH (à gauche) doit être placé en ligne entre le récipient de purge et le CLD si le test VCl3 dans HCl est effectué en raison de la corrosivité du HCl. La connexion au CLD nécessite toujours qu’un filtre diélectrique à champ intense (IFD) soit placé entre le CLD et la sortie du récipient de purge (ou du piège NaOH, le cas échéant). Le filtre IFD élimine les particules en suspension dans l’air et empêche le liquide de passer à travers le récipient de purge. PTFE = polytétrafluoroéthylène. Veuillez cliquer ici pour voir une version agrandie de cette figure.
En conséquence, tout composé pouvant être converti en NO par une réaction chimique spécifique et contrôlée peut être détecté avec une sensibilité élevée dans tout fluide biologique et homogénat tissulaire24. La mesure directe du NO en phase gazeuse par chimiluminescence est effectuée dans des contextes expérimentaux et cliniques. Ces techniques sont largement décrites ailleurs 33,34,35. La mesure du NO2–, des S-nitrosothiols, des protéines S-nitrosées et des Fe-NO peut être effectuée en ajoutant des échantillons dans un mélange réactionnel avec du triiodure (I3–), qui libère stœchiométriquement du GAZ NO de tous ces composés:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
tandis que I3– ne réagit pas avec NO 3-15. Des mesures précises de chaque composé sont rendues possibles par le prétraitement des aliquotes d’échantillons avec du sulfanilamide acidifié (AS) avec ou sans chlorure mercurique (HgCl2). Plus précisément, le prétraitement avec AS élimine toute lateneur en NO 2. En conséquence, la teneur en NO mesurée par le CLD ne reflète que la somme des concentrations de S-NO et de Fe-NOs. L’injection de HgCl2 dans une aliquote d’échantillon avant l’injection de SA provoque la libération de NO2– par S-NO. Le traitement par AS (conduisant à l’élimination du NO2) garantit que la teneur en NO mesurée ne reflète que la concentration de Fe-NO. Une série de soustractions entre les évaluations permet de calculer la concentration précise des trois dérivés du NO22.
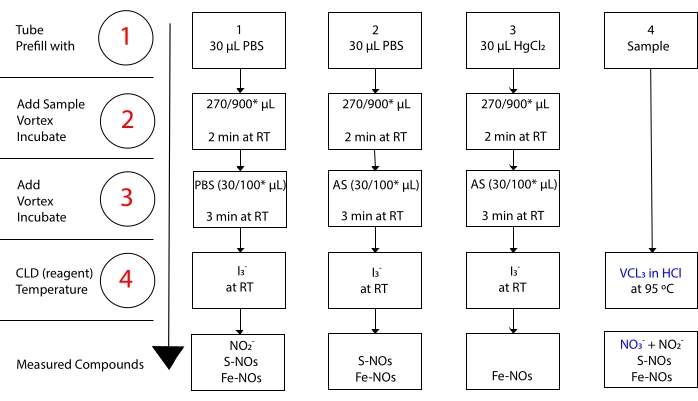
Figure 3 : Étapes de préparation de l’échantillon pour le test de chimiluminescence de l’acide acétiqueI3– dans l’acide acétique. Les étapes séquentielles de préparation du test de chimiluminescence de l’acideI3– dans l’acide acétique sont illustrées. L’utilisation de tubes centrifuges protégés contre la lumière est requise. Les tubes 1, 2 et 3 sont ceux utilisés pour préparer le test. Une autre aliquote d’échantillon (tube 4) est nécessaire pour le test VCl3 dans HCl si la mesure du nitrate (NO3–) est requise. Les étapes sont indiquées par des chiffres en rouge. Préremplir (étape 1) comme indiqué avec une solution saline tampon phosphate (PBS) ou HgCl2 avant d’ajouter le volume de l’échantillon. Ajouter le volume de l’échantillon (2) comme indiqué, vortex, et incuber pendant 2 min à température ambiante (RT). Ajouter (3) pbS ou sulfanilamide (AS) acidifié comme indiqué, vortex, et incuber pendant 3 min à TA. Exécuter le test (4). La concentration mesurée par le dosage est la somme de la concentration des composés rapportée sous chaque tube. Le tube numéro 1 permettra de mesurer les nitrites (NO2–), les S-nitrosothiols (S-NO) et les complexes fer-nitrosyle (Fe-NO) en un seul signal. Pour la mesure des nitrates (NO3–), les échantillons doivent être traités avec à la foisI3– dans l’acide acétique et VCl3 dans les dosages HCl, et la valeur obtenue à partir du tube 1 doit être soustraite de celle obtenue à partir du tube 4. *quantités suggérées à utiliser pour l’analyse de l’Hb pour la détermination du NO 2-résiduel, de la S-nitrosomémoglobine et de l’hémoglobine fer-nitrosyl. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour la mesure du NO3, le chlorure de vanadium (III) (VCl3) dans l’acide chlorhydrique (HCl) est utilisé pour la conversion du NO3– en NO dans le récipient de purge afin de mesurer le NO3– stœchiométriquement avec le CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Pour obtenir une conversion suffisamment rapide, la réaction doit être effectuée à 90-95 °C. La réduction de NO3– à NO2– est couplée à une réduction de NO2– à NO par HCl. Le vanadium métal réduit également les S-NO libérant leur fraction NO22,36. La concentration finale obtenue par CLD avecVCl3 dans HCl reflète la concentration globale de NO3–, NO2 et d’autres composés nitrosés. La soustraction de cette dernière valeur de la concentration obtenue avec CLD avec I3– permet de calculer la concentration de NO3– 36,37 (Figure 3).
Dans le test de consommation de NO, la libération continue de NO dans le récipient de purge par des donneurs de NO comme (Z)-1-[2-(2-aminoéthyl)-N-(2-ammonioéthyl)amino]diazène-1-ium-1,2-diolate (DETA-NONOate) génère un signal stable permettant de quantifier l’oxyHb sans cellule dans les échantillons injectés. La quantité de NO consommée dans le récipient de purge est en relation stœchiométrique avec la quantité d’oxyHb dans l’échantillon38.
Les protocoles de mesure des NO2, NO3, S-nitrosothiols, des complexes fer-nitrosyle et de LA CONSOMMATION DE NO par Hb sans cellules dans des échantillons de plasma sont illustrés. Les études sur le NO dans l’environnement RBC nécessitent un traitement spécifique de l’échantillon suivi d’une chromatographie d’exclusion pour mesurer les S-NO-Hb et Hb-NO extrêmement fragiles couplés à la détermination de la concentration totale d’Hb 15,22. La préparation des échantillons joue un rôle déterminant dans la correction de la mesure. La préexistence du NO2– dansH2Oet la libération du NO2– pendant le test peuvent conduire à la mesure de concentrations artificiellement plus élevées de dérivés du NO tels que le S-NO-Hb14,39. Des aspects importants de la préparation des échantillons sont également présentés.
Protocol
Representative Results
Discussion
En raison de la sensibilité élevée, les tests à base de chimiluminescence pour la détermination du NO et des composés apparentés présentent un risque élevé de contamination par le NO2. Chaque réactif (en particulier la solution bloquant le NO2) et chaque diluant (y compris le ddH2O) utilisé dans l’expérience doivent être testés pour sa teneur en NO2– afin de corriger le signal de fond. Le nitrite est extrêmement réactif avec u…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les protocoles rapportés dans ce manuscrit ont été rendus possibles grâce aux contributions accumulées par d’anciens boursiers du laboratoire de recherche en anesthésie en soins intensifs du Dr Warren Zapol, département d’anesthésie du Massachusetts General Hospital. Nous reconnaissons la contribution des Drs Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli et Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

