Kemiluminescensbaserade analyser för detektion av kväveoxid och dess derivat från autoxidation och nitroserade föreningar
Summary
Här presenterar vi protokoll för att detektera kväveoxid och dess biologiskt relevanta derivat med hjälp av kemiluminescensbaserade analyser med hög känslighet.
Abstract
Kväveoxid (NO) aktivitet in vivo är de kombinerade resultaten av dess direkta effekter, verkan av dess derivat genererade från NO-autoxidation och effekterna av nitroserade föreningar. Mätning av NO-metaboliter är avgörande för att studera NO-aktivitet både vid vaskulära nivåer och i andra vävnader, särskilt i experimentella miljöer där exogent NO administreras. Ozonbaserade kemiluminescensanalyser möjliggör exakta mätningar av NO- och NO-metaboliter i både vätskor (inklusive plasma, vävnadshomogenater, cellkulturer) och gasblandningar (t.ex. utandad andedräkt). NO reagerar med ozon för att generera kvävedioxid i ett upphetsat tillstånd. Den därav följande ljusemissionen möjliggör fotodesektion och generering av en elektrisk signal som återspeglar NO-innehållet i provet. Alikvoter från samma prov kan användas för att mäta specifika NO-metaboliter, såsom nitrat, nitrit, S-nitrosotiolaler och järn-nitrosylkomplex. Dessutom kvantifieras NO som konsumeras av cellfritt hemoglobin också med kemiluminescensanalys. En illustration av alla dessa tekniker tillhandahålls.
Introduction
Sedan Salvador Moncada och Nobelpristagarna Robert Furchgott, Louis Ignarro och Ferid Murad identifierade kväveoxid (NO) som den tidigare kända endotel-härledda avslappningsfaktorn (EDRF), har NO: s centrala roll fastställts i flera nyckelmekanismer som spänner över hela vaskulär biologi, neurovetenskap, metabolism och värdrespons 1,2,3,4,5,6,7 . Exogen administrering av NO-gas har blivit en etablerad behandling för andningssvikt på grund av pulmonell hypertension hos nyfödda8. Kväveoxidgas har också undersökts för behandling av respiratorisk syncytialvirusinfektion (RSV), malaria och andra infektionssjukdomar, ischemi-reperfusionsskada och för förebyggande av akut njurskada hos patienter som genomgår hjärtkirurgi 9,10,11,12. Behovet av exakta mättekniker för att bedöma nivåerna av NO, dess metaboliter och nivåerna av dess målproteiner och föreningar härrör från både mekanistiska och interventionella studier.
På grund av sin höga reaktivitet kan NO genomgå olika reaktioner beroende på den biologiska matrisen i vilken den produceras och/eller friges. I frånvaro av hemoglobin (Hb) eller andra oxihemoproteiner oxideras NO nästan helt till nitrit (NO2–).
2NO + O2 →2NO2
NO2 + NO →N2O3
N2O3+H2O→NO2– + H +
NO genomgår först autoxidation med molekylärt syre (O2) för att ge kvävedioxid (NO2) och reagerar med NO2 själv för att generera dikvävetrioxid (N2O3). En molekyl avN2O3reagerar med vatten (H2O) för att bilda två molekyler av NO2– och en proton (H+)13. Inom helblodomvandlas 14,15, NO och NO2– snabbt till nitrat (NO3–) eftersom dessa molekyler reagerar ivrigt med de oxiderade hemgrupperna av Hb [Hb-Fe2+–O2 eller oxyhemoglobin (oxyHb)] för att ge NO 3–. Denna reaktion är kopplad till övergången av hemgruppen till järntillståndet [Hb-Fe3+ eller methemoglobin (metHb)]:
Hb-Fe2+–O2 + INGEN → Hb-Fe3+ + NO3–
Barriären för röda blodkroppar (RBC) och utrymmet omedelbart intill endotelet är de viktigaste faktorerna som begränsar denna reaktion och tillåter en liten del av NO som frigörs av endotelet att fungera som EDRF16,17. Faktum är att cellfritt Hb i cirkulationen är känt för att störa vasodilatation i experimentella och kliniska miljöer17,18. Inom RBC, beroende på syresättning och NO 2-koncentration, reagerar en del av NO med deoxihemoglobin (Hb-Fe2+) för att bilda järn-nitrosyl Hb (Hb-Fe2+-NO eller HbNO):
Hb-Fe2+ + INGEN → Hb-Fe2+-NO
I RBC15,17 kan NO2– bilda Hb-Fe3+ genom att reducera Hb-Fe2+ vilket leder till frisättning av NO, vilket i sin tur binder Hb-Fe2+–O2 (företrädesvis) eller Hb-Fe2+.
Genereringen av NO-derivat bör inte betraktas som strikt enkelriktad eftersom NO kan regenereras från NO2– ochNO3– i olika vävnader och av olika enzymer (t.ex. av tarmbakterier eller inom mitokondrier, särskilt under hypoxiska förhållanden)19,20.
En varierande mängd NO som produceras (eller administreras) leder till nedströms generering av S-nitrosotioler, huvudsakligen genom tioltransnitrosation frånN2O3i närvaro av en nukleofil som skapar en NO+ givarmediär (Nuc-NO+-NO2–):
N2O3+ RS– → RS-NO + NO 2–
En annan möjlighet för S-nitrosotioler generering är nitrosylering av oxiderade tioler (NO reagerar med en oxiderad tiol):
RS• + INGEN → RS-NO
Denna mekanism och direkt tioloxidation med NO2 kan vara möjlig endast under mycket specifika förhållanden som beskrivs någon annanstans21. S-nitrosotioler sträcker sig från ljusmolekyler som S-nitrosoglutation till stora tiolhaltiga proteiner. S-nitrosohemoglobin (S-NO-Hb) bildas genom nitrosering av en tiolgrupp av en konserverad cysteinrest i β-chain (β93C)22.
Genereringen och metabolismen av S-nitrosotiolaler är en del av viktiga regleringsmekanismer. Exempel inkluderar reglering av glutation, kaspaser, N-metyl-D-aspartat (NMDA) och ryanodinreceptorer 23,24,25,26,27,28. Nitroserat albumin (S-nitroso-albumin) har tidigare betraktats som en viktig medlare av NO-biologi in vivo och verkar vara en NO/NO+-transportör utan någon specifik ytterligare biologisk aktivitet29.
Vid mätning av koncentrationen av NO och dess derivat från ett specifikt biologiskt prov inom en biologisk matris är det viktigt att överväga egenskaper som surhet, syresättning, temperatur och närvaron av reagenser. Exempel inkluderar administrerade exogena NO-givare och, vid inställning av akut inflammation, väteperoxid (H2O2) som reagerar med NO2 vilket leder till generering av supernormal koncentration av fria radikaler som peroxinitrit (ONOO–)21. Förutom den analysmetod som används är den preanalytiska fasen av provberedning och lagring grundläggande. Reaktioner nedströms som inte representerar in vivo NO-aktiviteten ska förutsägas, beaktas och blockeras. Ett giltigt exempel är instabiliteten hos S-NO-Hb, som kräver en särskild behandling av blodprover när den är avsedd för mätning22.
Kemiluminescensbaserade analyser är guldstandarden för att detektera nivåerna av NO och dess huvudmetaboliter [NO 2–,NO3-, S-NO och järn-nitrosylkomplex (Fe-NO)] i någon biologisk vätska, inklusive vävnadshomogenater 30,31. Dessa metoder bygger på kemiluminescensdetektorn (CLD), en anordning som rymmer reaktionen av NO med ozon (O3), vilket genererar NO2 i ett exciterat tillstånd (NO2•). Avslappning av NO2• orsakar utsläpp av en foton av ljus som detekteras av ett fotomultiplikerarrör, vilket genererar en elektrisk signal som är direkt proportionell mot NO-halten i den samplade gasblandningen32. Ett förenklat schema över CLD representeras.
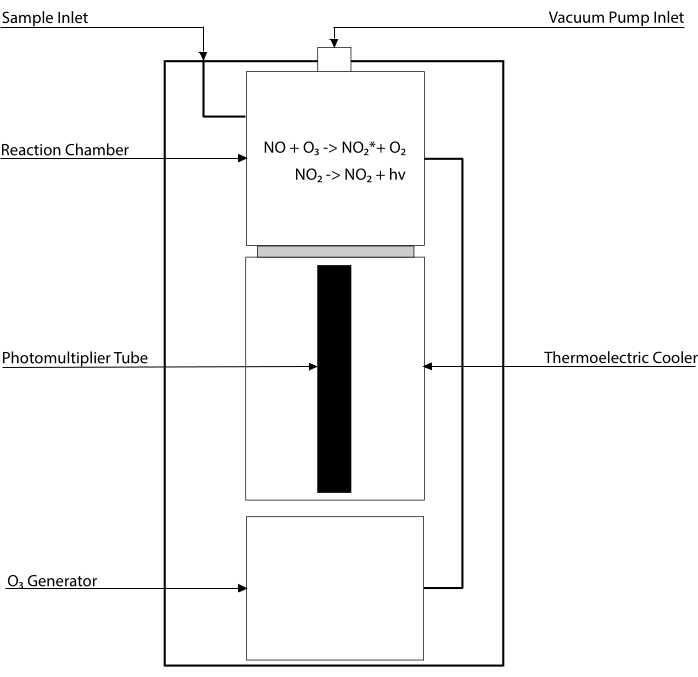
Figur 1: Förenklat schema över en kemiluminescensdetektor för kväveoxidgas. Kemiluminescensbaserad detektion av kväveoxid (NO) är den stökiometriska generationen av en foton per NO-gasmolekyl som införs i kemiluminescensdetektorn (CLD). Kemiluminescensreaktionen erhålles i en utsedd kammare försedd med ozon (O3) från en intern generator, som hålls vid undertryck genom anslutning till en extern pump, vilket möjliggör kontinuerligt och konstant inflöde av provgas. Genereringen avO3 kräver diatomiskt syre (O2) som levereras av en dedikeradO2-tank ansluten till CLD (andra tillverkare tillhandahåller CLD som arbetar med omgivande luft). Inom reaktionskammaren reagerar varje molekyl av NO-gas som finns i den provterade gasen med syre för att ge en molekyl kvävedioxid i aktiverat tillstånd (NO2*). Genom att återgå till sitt marktillstånd avger varjeNO2*-molekyl en foton som detekteras av ett fotomultiplikorrör (PMT) som ligger intill reaktionskammaren. PMT med tillhörande förstärkare och centralprocessor producerar en signal som är proportionell mot fotontalet och antalet NO-molekyler i reaktionskammaren. Klicka här för att se en större version av denna figur.
CLD:s provingringsprov kan anslutas till ett glassystem som innehåller en reaktionskammare för vätskeprover. Systemet rensas kontinuerligt med en inert gas såsom kväve, helium eller argon, vilket överför NO från reaktionskammaren till CLD. Vätskefasprover injiceras genom ett dedikerat membran i reningskärlet.
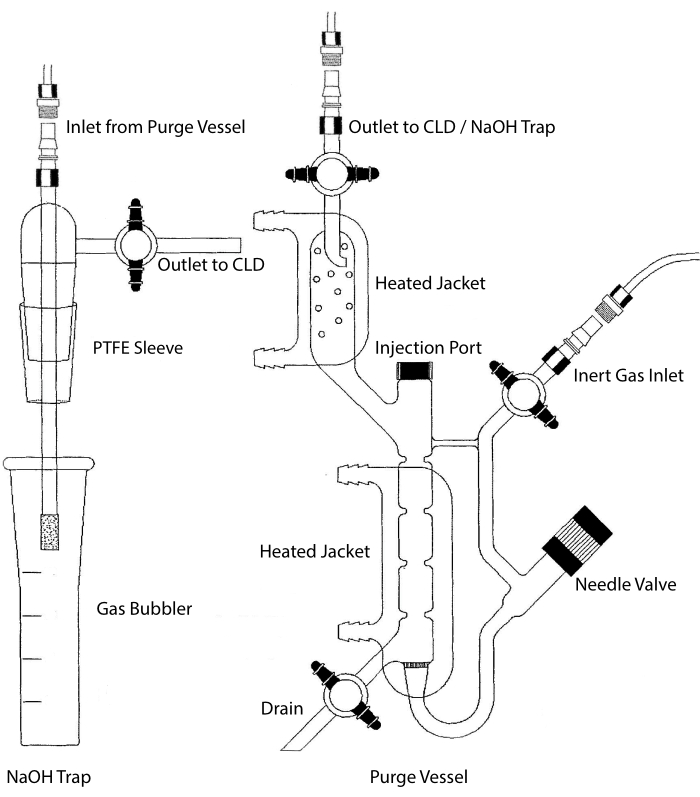
Figur 2: Struktur av ett reningskärl för kemiluminescensbaserad detektion av kväveoxidgas Reningskärlet (höger) möjliggör detektion av kväveoxid (NO) gas eller någon annan förening som lätt kan omvandlas till INGEN gas när den frigörs från ett vätskefasreagens. Det inerta gasinloppet är anslutet till en källa (tank) till en inert gas såsom Argon, Xeon eller diatomiskt kväve (N2). Nålventilen (öppnas till vänster) används för tryckreglering i reningskärlet och kan tas bort helt för att rengöra kärlet. Injektionsporten är täckt av ett lock med ett membranseptum för provinjektion. Membranet bör bytas ut ofta. En uppvärmd mantel omger reaktionskammaren och är ansluten till ett varmvattenbad för att utföra VCl3 i HCl-analysen. Reningskärlets utlopp är anslutet till kemiluminescensdetektorn (CLD) eller till NaOH-fällan (krävs för VCl3 i HCl-analyser). För att tömma reaktionskammarens innehåll, stäng först stoppkranarna vid det inerta gasinloppet och rensningskärlets utlopp, stäng nålventilen, ta bort locket vid injektionsporten och öppna slutligen stoppkranen vid avloppet. NaOH-fällan (vänster) måste placeras inline mellan reningskärlet och CLD om VCl3 i HCl-analysen utförs på grund av frätandet av HCl. Anslutningen till CLD kräver alltid att ett intensivt fältdielektriskt (IFD) filter placeras mellan CLD och utgången från rensningskärlet (eller NaOH-fällan, om den används). IFD-filtret tar bort luftburna partiklar och hindrar vätska från att passera genom reningskärlet. PTFE = polytetrafluoretylen. Klicka här för att se en större version av denna figur.
Som en konsekvens kan varje förening som kan omvandlas till NO genom en specifik och kontrollerad kemisk reaktion detekteras med hög känslighet i vilken biologisk vätska och vävnadshomogenat som helst24. Direkt mätning av gasfas NO genom kemiluminescens utförs i både experimentella och kliniska miljöer. Dessa tekniker beskrivs utförligt någon annanstans 33,34,35. Mätning av NO2–, S-nitrosotioler, S-nitroserade proteiner och Fe-NOs kan utföras genom tillsats av prover i en reaktionsblandning med trijodid (I3–), som stökiometriskt frigör INGEN gas från alla dessa föreningar:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO +I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
medan jag3– inte reagerar med NO 3-15. Exakta mätningar av varje förening möjliggörs genom förbehandling av provalikvoter med surgjord sulfanilamid (AS) med eller utan kvicksilverklorid (HgCl2). Specifikt tar förbehandling med AS bort allt NO 2-innehåll. Till följd av detta återspeglar NO-halten mätt med CLD endast summan av koncentrationen av S-NOs och Fe-NOs. Injektion avHgCl2 i ett prov alikvot före AS-injektion orsakar att NO2– frigörs av S-NO. Behandling med AS (vilket leder till borttagning av NO2) säkerställer att den uppmätta NO-halten endast återspeglar koncentrationen av Fe-NO. En serie subtraktioner mellan bedömningarna gör det möjligt att beräkna den exakta koncentrationen av de tre NO-derivaten22.
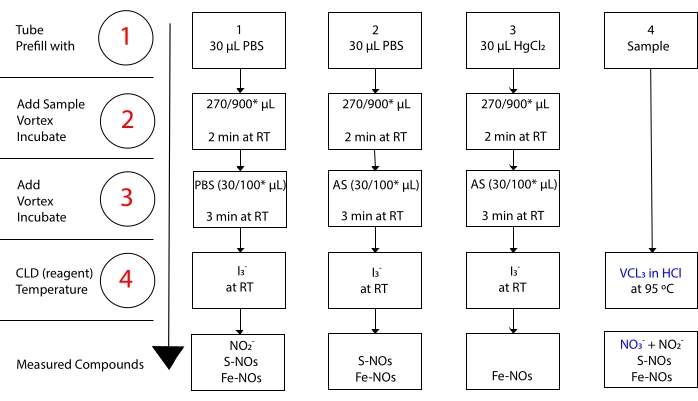
Figur 3: Steg i provberedningen för I3– i ättiksyrakemiluminiscensanalysen. De sekventiella stegen för framställning av I3– i ättiksyrakemiluminiscensanalys illustreras. Användning av ljusskyddade centrifugrör krävs. Rör 1, 2 och 3 är de som används för att förbereda sig för analysen. En annan provalimit (rör 4) behövs förVCl3 i HCl-analysen om mätning av nitrat (NO3-) krävs. Steg indikeras med siffror i rött. Förfyllning (steg 1) enligt vad som anges med fosfatbuffertsaltlösning (PBS) ellerHgCl2 innan provvolymen tillsätts. Tillsätt provvolymen (2) enligt anvisningarna, virvel och inkubera i 2 minuter vid rumstemperatur (RT). Tillsätt (3) PBS eller surgjord sulfanilamid (AS) enligt anvisningarna, virvel och inkubera i 3 min vid RT. Kör analysen (4). Den koncentration som mäts med analysen är summan av koncentrationen av de föreningar som rapporterats under varje rör. Rör nummer 1 möjliggör mätningar av nitrit (NO2–), S-nitrosotiolaler (S-NO) och järn-nitrosylkomplex (Fe-NOs) som en enda signal. För nitratmätning (NO3-) ska proverna köras med både I 3-i ättiksyra och VCl3 i HCl-analyser, och det värde som erhålls från rör 1 ska subtraheras från det som erhålls från rör 4. *föreslagna kvantiteter som ska användas för Hb-analys för bestämning av kvarvarande NO2–, S-nitrosohemoglobin och järn-nitrosyl-hemoglobin. Klicka här för att se en större version av denna figur.
För NO 3-mätning används vanadin (III)klorid (VCl3) i saltsyra (HCl) för omvandling av NO3– till NO i reningskärlet för att mäta NO 3-stökiometriskt med CLD:
2 NO3–+ 3V + 3 + 2H2 O → 2NO+ 3VO2+ + 4H+
För att uppnå en tillräckligt snabb omvandling måste reaktionen utföras vid 90-95 °C. Reduktion från NO3– till NO2– är kopplad till reduktion av NO2– till NO med HCl. Vanadinmetall minskar också S-NOs som frigör sin NO-del22,36. Den slutliga koncentrationen erhållen genom CLD medVCl3 i HCl återspeglar den aggregerade koncentrationen avNO3–,NO2– och andra nitroserade föreningar. Subtraktion av det senare värdet från den koncentration som avges med CLD med I3– möjliggör beräkning av NO 3-koncentration 36,37 (figur 3).
I NO-konsumtionsanalysen genererar den kontinuerliga frisättningen av NO i reningskärlet av NO-givare som (Z)-1-[2-(2-aminoetyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolat (DETA-NONOate) en stabil signal som möjliggör kvantifiering av cellfri oxyHb i de injicerade proverna. Mängden NO som konsumeras i reningskärlet är i ett stökiometriskt förhållande till mängden oxyHb i provet38.
Protokoll för mätning av NO2–,NO3–, S-nitrosotiolaler, järn-nitrosylkomplex och NO-konsumtion med cellfritt Hb i plasmaprover illustreras. Studier av NO i RBC-miljön kräver specifik provbehandling följt av uteslutningskromatografi för att mäta extremt ömtålig S-NO-Hb och Hb-NO i kombination med bestämning av total Hb-koncentration15,22. Provberedning är avgörande för att korrigera mätningen. Förekomst av NO2– iH2Ooch frisättning av NO2– under analysen kan leda till mätning av artificiellt högre koncentrationer av NO-derivat såsom S-NO-Hb14,39. Viktiga aspekter av provberedning presenteras också.
Protocol
Representative Results
Discussion
På grund av den höga känsligheten har kemiluminescensbaserade analyser för bestämning av NO och besläktade föreningar en hög risk för NO 2-kontaminering. Varje reagens (särskilt NO 2-blockerande lösning) och spädningsmedel (inklusive ddH2O) som används i experimentet bör testas för dess NO 2-innehåll för att korrigera för bakgrundssignal. Nitrit är extremt reaktivt med en halveringstid i helblod runt 10 min och genererar snabb…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Protokollen som rapporteras i detta manuskript möjliggjordes av de ackumulerade bidragen från tidigare kamrater från Dr. Warren Zapols laboratorium för anestesiforskning i kritisk vård, avdelningen för anestesi vid Massachusetts General Hospital. Vi erkänner bidraget från Drs. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli och Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

