أداء في فيفو و السابقين فيفو المقاومة الكهربائية Myography في القوارض
Summary
توضح هذه المقالة بالتفصيل كيفية الأداء في الجسم الحي (باستخدام صفائف الأقطاب الكهربائية السطحية والإبرة) وخارج الجسم الحي (باستخدام خلية عازلة) تخطيط عضلات المعاوقة الكهربائية على عضلة القوارض المعدية القوارض. وسوف تظهر هذه التقنية في كل من الفئران والجرذان وتفصل التعديلات المتاحة ، (أي الحيوانات البدينة، والجراء).
Abstract
التصوير العضلي للمعاوقة الكهربائية (EIM) هو تقنية مريحة يمكن استخدامها في الدراسات قبل السريرية والسريرية لتقييم صحة الأنسجة العضلية والمرض. يتم الحصول على EIM عن طريق تطبيق تيار كهربائي منخفض الكثافة ومركز اتجاهيا على عضلة ذات أهمية عبر مجموعة من الترددات (أي من 1 كيلو هرتز إلى 10 ميجاهرتز) وتسجيل الفولتية الناتجة. من هذه ، يتم الحصول على العديد من مكونات المعاوقة القياسية ، بما في ذلك التفاعل والمقاومة والطور. عند إجراء قياسات خارج الجسم الحي على العضلات المستثناة ، يمكن أيضا حساب الخصائص الكهربائية السلبية المتأصلة في الأنسجة ، أي الموصلية والسماحية النسبية. تم استخدام EIM على نطاق واسع في الحيوانات والبشر لتشخيص وتتبع تغيرات العضلات في مجموعة متنوعة من الأمراض ، فيما يتعلق بضمور عدم الاستخدام البسيط ، أو كمقياس للتدخل العلاجي. سريريا ، توفر EIM إمكانية تتبع تطور المرض بمرور الوقت وتقييم تأثير التدخلات العلاجية ، مما يتيح الفرصة لتقصير مدة التجربة السريرية وتقليل متطلبات حجم العينة. نظرا لأنه يمكن إجراؤه بشكل غير جراحي أو بأقل قدر من التدخل الجراحي في النماذج الحيوانية الحية وكذلك البشر ، فإن EIM يوفر إمكانية العمل كأداة انتقالية جديدة تمكن من التطور قبل السريري والسريري. توفر هذه المقالة إرشادات خطوة بخطوة حول كيفية إجراء قياسات EIM في الجسم الحي وخارج الجسم الحي في الفئران والجرذان ، بما في ذلك طرق تكييف التقنيات مع ظروف محددة ، مثل استخدامها في الجراء أو الحيوانات البدينة.
Introduction
يوفر التصوير العضلي للمعاوقة الكهربائية (EIM) طريقة قوية لتقييم حالة العضلات ، مما قد يمكن من تشخيص الاضطرابات العصبية العضلية ، وتتبع تطور المرض ، وتقييم الاستجابة للعلاج1،2،3. يمكن تطبيقه بشكل مماثل على نماذج الأمراض الحيوانية والبشر ، مما يسمح بترجمة سلسة نسبيا من الدراسات قبل السريرية إلى الدراسات السريرية. يمكن الحصول على قياسات EIM بسهولة باستخدام أربعة أقطاب كهربائية موضوعة خطيا ، حيث يطبق القطبان الخارجيان تيارا كهربائيا ضعيفا وغير مؤلم عبر مجموعة من الترددات (عادة بين 1 كيلو هرتز وحوالي 2 ميجاهرتز) ، ويسجل الاثنان الداخليان الفولتية الناتجة1. من هذه الفولتية ، يمكن الحصول على خصائص مقاومة الأنسجة ، بما في ذلك المقاومة (R) ، وهو مقياس لمدى صعوبة مرور التيار عبر الأنسجة ، والمتفاعل (X) أو “قابلية الشحن” للنسيج ، وهو مقياس يتعلق بقدرة الأنسجة على تخزين الشحنة (السعة). من التفاعل والمقاومة ، يتم حساب زاوية الطور (θ) عبر المعادلة التالية: 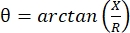 ، مما يوفر مقياسا واحدا للمعاوقة التحصيلية. يمكن الحصول على هذه القياسات باستخدام أي جهاز معاوقة بيولوجية متعدد الترددات. نظرا لأن الألياف العضلية هي في الأساس أسطوانات طويلة ، فإن الأنسجة العضلية هي أيضا متباينة للغاية ، حيث يتدفق التيار بسهولة أكبر على طول الألياف مقارنة عبرها 4,5. وبالتالي ، غالبا ما يتم إجراء EIM في اتجاهين: مع وضع الصفيف على طول الألياف بحيث يعمل التيار بالتوازي معها ، وعبر العضلات بحيث يتدفق التيار عموديا عليها. بالإضافة إلى ذلك ، في القياسات خارج الجسم الحي ، حيث يتم قياس حجم معروف من الأنسجة في خلية قياس المعاوقة ، يمكن اشتقاق الخصائص الكهربائية المتأصلة للعضلة (أي الموصلية والسماحية النسبية) ،6.
، مما يوفر مقياسا واحدا للمعاوقة التحصيلية. يمكن الحصول على هذه القياسات باستخدام أي جهاز معاوقة بيولوجية متعدد الترددات. نظرا لأن الألياف العضلية هي في الأساس أسطوانات طويلة ، فإن الأنسجة العضلية هي أيضا متباينة للغاية ، حيث يتدفق التيار بسهولة أكبر على طول الألياف مقارنة عبرها 4,5. وبالتالي ، غالبا ما يتم إجراء EIM في اتجاهين: مع وضع الصفيف على طول الألياف بحيث يعمل التيار بالتوازي معها ، وعبر العضلات بحيث يتدفق التيار عموديا عليها. بالإضافة إلى ذلك ، في القياسات خارج الجسم الحي ، حيث يتم قياس حجم معروف من الأنسجة في خلية قياس المعاوقة ، يمكن اشتقاق الخصائص الكهربائية المتأصلة للعضلة (أي الموصلية والسماحية النسبية) ،6.
يعرف مصطلح “الاضطرابات العصبية العضلية” مجموعة واسعة من الأمراض الأولية والثانوية التي تؤدي إلى تغيير العضلات الهيكلية واختلال وظائفها. وهذا يشمل التصلب الجانبي الضموري وأشكال مختلفة من ضمور العضلات ، وكذلك التغيرات الأبسط المتعلقة بالشيخوخة (على سبيل المثال ، ساركوبينيا) ، أو ضمور عدم الاستخدام (على سبيل المثال ، بسبب الراحة الطويلة في الفراش أو الجاذبية الصغرى) أو حتى الإصابة7. في حين أن الأسباب وفيرة ويمكن أن تنشأ من الخلايا العصبية الحركية أو الأعصاب أو التقاطعات العصبية العضلية أو العضلات نفسها ، يمكن استخدام EIM للكشف عن التغيرات المبكرة في العضلات بسبب العديد من هذه العمليات وتتبع التقدم أو الاستجابة للعلاج. على سبيل المثال ، في المرضى الذين يعانون من ضمور العضلات دوشين (DMD) ، ثبت أن EIM يكتشف تطور المرض والاستجابة للكورتيكوستيرويدات8. وقد أظهرت الأبحاث الحديثة أيضا أن EIM حساسة لحالات عدم الاستخدام المختلفة ، بما في ذلك الجاذبية الجزئية9 ، كما هو الحال على القمر أو المريخ ، وآثار الشيخوخة10,11. أخيرا ، من خلال تطبيق خوارزميات التنبؤ والتعلم الآلي على مجموعة البيانات التي تم الحصول عليها مع كل قياس (بيانات متعددة الترددات ومعتمدة على الاتجاه) ، يصبح من الممكن استنتاج الجوانب النسيجية للأنسجة ، بما في ذلك حجم الألياف العضلية12,13 ، والتغيرات الالتهابية والوذمة 14 ، والنسيج الضام ومحتوى الدهون15,16.
كما تستخدم العديد من الطرق الأخرى غير الغازية أو طفيفة التوغل لتقييم صحة العضلات لدى البشر والحيوانات ، بما في ذلك تخطيط كهربية العضلات بالإبرة17 وتقنيات التصوير مثل التصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب والموجات فوق الصوتية18,19. ومع ذلك ، يوضح EIM فوائد متميزة مقارنة بهذه التقنيات. على سبيل المثال ، يسجل تخطيط كهربية العضلات فقط الخصائص الكهربائية النشطة لأغشية الألياف العضلية وليس الخصائص السلبية ، وبالتالي لا يمكن أن يوفر تقييما حقيقيا لتكوين العضلات أو بنيتها. في بعض النواحي ، ترتبط طرق التصوير ارتباطا وثيقا ب EIM ، لأنها توفر أيضا معلومات حول بنية الأنسجة وتكوينها. ولكن بمعنى ما ، فإنها توفر الكثير من البيانات ، مما يتطلب تجزئة مفصلة للصور وتحليل الخبراء بدلا من مجرد توفير ناتج كمي. وعلاوة على ذلك، ونظرا لتعقيداتها، تتأثر تقنيات التصوير أيضا تأثرا كبيرا بخصائص كل من الأجهزة والبرامج المستخدمة، مما يتطلب من الناحية المثالية استخدام أنظمة متطابقة بحيث يمكن مقارنة مجموعات البيانات. في المقابل ، فإن حقيقة أن EIM أبسط بكثير تعني أنها أقل تأثرا بهذه المشكلات الفنية ولا تتطلب أي شكل من أشكال معالجة الصور أو تحليل الخبراء.
يوضح البروتوكول التالي كيفية الأداء في الجسم الحي EIM في الجرذان والفئران ، باستخدام كل من التقنيات غير الغازية (الصفيف السطحي) وطفيفة التوغل (صفيف الإبرة تحت الجلد) ، بالإضافة إلى EIM خارج الجسم الحي على العضلات المستأصلة حديثا.
Protocol
Representative Results
Discussion
توفر هذه المقالة الطرق الأساسية لأداء EIM في القوارض ، سواء في الجسم الحي أو الجسم الحي السابق. للحصول على قياسات موثوقة ، من الأهمية بمكان تنفيذ سلسلة من الخطوات. أولا ، يحتاج المرء إلى تحديد العضلات ذات الاهتمام بشكل صحيح ، حيث سيكون لكل عضلة استجابات مختلفة للأمراض والعلاج والأ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل صندوق تشارلي والمعاهد الوطنية للصحة R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

