ביצוע מיוגרפיה של עכבה חשמלית In Vivo ו - Ex Vivo במכרסמים
Summary
מאמר זה מפרט כיצד לבצע in vivo (באמצעות מערכי אלקטרודות משטח ומחט) ו- ex vivo (באמצעות תא דיאלקטרי) מיופיוגרפיה של עכבה חשמלית על שריר גסטרוקנמיוס המכרסמים. הוא ידגים את הטכניקה הן בעכברים והן בחולדות ויפרט את השינויים הזמינים, (כלומר, בעלי חיים שמנים, גורים).
Abstract
מיוגרפיה של עכבה חשמלית (EIM) היא טכניקה נוחה שניתן להשתמש בה במחקרים פרה-קליניים וקליניים להערכת בריאות ומחלות של רקמות שריר. EIM מתקבל על ידי הפעלת זרם חשמלי בעוצמה נמוכה, ממוקד כיוון, על שריר בעל עניין על פני טווח של תדרים (כלומר, מ 1 kHz עד 10 MHz) ורישום המתחים המתקבלים. מאלה מתקבלים מספר רכיבי עכבה סטנדרטיים, כולל התגובה, ההתנגדות והפאזה. בעת ביצוע מדידות ex vivo על שריר נכרת, ניתן לחשב גם את התכונות החשמליות הפסיביות הטבועות ברקמה, כלומר המוליכות וההיתר היחסי. EIM נמצא בשימוש נרחב בבעלי חיים ובבני אדם כדי לאבחן ולעקוב אחר שינויים בשרירים במגוון מחלות, ביחס לאטרופיה פשוטה, או כמדד להתערבות טיפולית. מבחינה קלינית, EIM מציע את הפוטנציאל לעקוב אחר התקדמות המחלה לאורך זמן ולהעריך את ההשפעה של התערבויות טיפוליות, ובכך להציע את ההזדמנות לקצר את משך הניסוי הקליני ולהפחית את דרישות גודל הדגימה. מכיוון שניתן לבצע אותו באופן לא פולשני או זעיר פולשני במודלים של בעלי חיים חיים כמו גם בבני אדם, EIM מציע את הפוטנציאל לשמש ככלי תרגום חדשני המאפשר פיתוח פרה-קליני וקליני כאחד. מאמר זה מספק הוראות שלב אחר שלב כיצד לבצע מדידות in vivo ו- ex vivo EIM בעכברים ובחולדות, כולל גישות להתאמת הטכניקות לתנאים ספציפיים, כגון לשימוש בגורים או בבעלי חיים שמנים.
Introduction
מיוגרפיה של עכבה חשמלית (EIM) מספקת שיטה רבת עוצמה להערכת מצב השרירים, ועשויה לאפשר אבחון של הפרעות נוירומוסקולריות, מעקב אחר התקדמות המחלה והערכת התגובה לטיפול 1,2,3. ניתן ליישם אותו באופן אנלוגי למודלים של מחלות בעלי חיים ולבני אדם, מה שמאפשר תרגום חלק יחסית ממחקרים פרה-קליניים למחקרים קליניים. מדידות EIM מתקבלות בקלות באמצעות ארבע אלקטרודות הממוקמות באופן ליניארי, כאשר שתי החיצוניות מפעילות זרם חשמלי חלש ללא כאבים בטווח תדרים (בדרך כלל בין 1 קילוהרץ לכ-2 מגה-הרץ), ושתי הפנימיות רושמות את המתחים המתקבלים1. ממתחים אלה ניתן לקבל את מאפייני העכבה של הרקמה, כולל ההתנגדות (R), מדד של כמה קשה לזרם לעבור דרך הרקמה, והתגובה (X) או “הטעינה” של הרקמה, מדד הקשור ליכולת של הרקמה לאחסן מטען (קיבוליות). מהתגובה וההתנגדות, זווית הפאזה (θ) מחושבת באמצעות המשוואה הבאה: 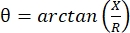 , המספקת מידה אחת של עכבה מסכמת. מדידות כאלה ניתן להשיג באמצעות כל מכשיר bioimpedance רב תדרים. מכיוון שמיופייברים הם למעשה גלילים ארוכים, רקמת השריר היא גם אניזוטרופית מאוד, עם זרם זורם בקלות רבה יותר לאורך סיבים מאשר על פניהם 4,5. לפיכך, EIM מבוצע לעתים קרובות בשני כיוונים: כאשר המערך ממוקם לאורך הסיבים כך שהזרם פועל במקביל אליהם, ולרוחב השריר כך שהזרם זורם בניצב אליהם. בנוסף, מדידות in ex vivo, שבהן נפח ידוע של רקמה נמדד בתא מדידת עכבה, ניתן לגזור את התכונות החשמליות הטבועות בשריר (כלומר המוליכות וההיתר היחסי),6.
, המספקת מידה אחת של עכבה מסכמת. מדידות כאלה ניתן להשיג באמצעות כל מכשיר bioimpedance רב תדרים. מכיוון שמיופייברים הם למעשה גלילים ארוכים, רקמת השריר היא גם אניזוטרופית מאוד, עם זרם זורם בקלות רבה יותר לאורך סיבים מאשר על פניהם 4,5. לפיכך, EIM מבוצע לעתים קרובות בשני כיוונים: כאשר המערך ממוקם לאורך הסיבים כך שהזרם פועל במקביל אליהם, ולרוחב השריר כך שהזרם זורם בניצב אליהם. בנוסף, מדידות in ex vivo, שבהן נפח ידוע של רקמה נמדד בתא מדידת עכבה, ניתן לגזור את התכונות החשמליות הטבועות בשריר (כלומר המוליכות וההיתר היחסי),6.
המונח “הפרעות נוירומוסקולריות” מגדיר מגוון רחב של מחלות ראשוניות ומשניות המובילות לשינוי מבניים בשרירים ולתפקוד לקוי. זה כולל טרשת אמיוטרופית צידית וצורות שונות של ניוון שרירים, כמו גם שינויים פשוטים יותר הקשורים להזדקנות (למשל, סרקופניה), ניוון דיס-שימוש (למשל, עקב משענת מיטה ממושכת או מיקרו-כבידה) או אפילו פציעה7. בעוד שהסיבות הן בשפע ויכולות לנבוע מהנוירון המוטורי, העצבים, הצמתים העצביים-שריריים או השריר עצמו, ניתן להשתמש ב- EIM כדי לזהות שינויים מוקדמים בשריר עקב רבים מהתהליכים הללו ולעקוב אחר התקדמות או תגובה לטיפול. לדוגמה, בחולים עם ניוון שרירים דושן (DMD), הוכח כי EIM מזהה התקדמות המחלה ותגובתה לקורטיקוסטרואידים8. עבודות אחרונות הראו גם ש-EIM רגיש למצבי דיס-שימוש משתנים, כולל כבידה חלקית9, כפי שחווים על הירח או על מאדים, וההשפעות של הזדקנות10,11. לבסוף, על ידי החלת אלגוריתמים של חיזוי ולמידת מכונה על מערך הנתונים המתקבל עם כל מדידה (נתונים בתדירות גבוהה ותלויי כיוון), ניתן להסיק היבטים היסטולוגיים של הרקמה, כולל גודל מיופייבר 12,13, שינויים דלקתיים ובצקת14, ותכולת רקמת חיבור ושומן 15,16.
מספר שיטות לא פולשניות אחרות או פולשניות מינימליות משמשות גם להערכת בריאות השרירים בבני אדם ובבעלי חיים, כולל אלקטרומיוגרפיה של מחט17 וטכנולוגיות הדמיה כגון הדמיית תהודה מגנטית, טומוגרפיה ממוחשבת ואולטרסאונד18,19. עם זאת, EIM מדגים יתרונות מובהקים בהשוואה לטכנולוגיות אלה. לדוגמה, אלקטרומיוגרפיה מתעדת רק את התכונות החשמליות הפעילות של קרומי המיופייבר ולא את התכונות הפסיביות, ולכן אינה יכולה לספק הערכה אמיתית של הרכב או מבנה השרירים. במובן מסוים, שיטות הדמיה קשורות קשר הדוק יותר EIM, שכן גם הם מספקים מידע על המבנה וההרכב של רקמות. אבל במובן מסוים, הם מספקים יותר מדי נתונים, ודורשים סגמנטציה מפורטת של תמונות וניתוח מומחים ולא רק מספקים פלט כמותי. יתר על כן, בהתחשב במורכבות שלהם, טכניקות הדמיה מושפעות מאוד גם מהפרטים של החומרה והתוכנה שבשימוש, באופן אידיאלי דורשות שימוש במערכות זהות כך שניתן להשוות בין מערכי נתונים. לעומת זאת, העובדה ש- EIM הוא הרבה יותר פשוט פירושה שהוא פחות מושפע מבעיות טכניות אלה ואינו דורש כל צורה של עיבוד תמונה או ניתוח מומחה.
הפרוטוקול הבא מדגים כיצד לבצע in vivo EIM בחולדות ובעכברים, תוך שימוש הן בטכניקות לא פולשניות (מערך פני השטח) והן בטכניקות זעיר פולשניות (מערך מחטים תת-עורי), כמו גם ex vivo EIM על שריר שזה עתה נכרת.
Protocol
Representative Results
Discussion
מאמר זה מספק את השיטות הבסיסיות לביצוע EIM במכרסמים, הן in vivo והן ex vivo. כדי להשיג מדידות אמינות, זה קריטי לבצע סדרה של צעדים. ראשית, יש לזהות כראוי את שריר העניין, שכן לכל שריר יהיו תגובות שונות למחלות, טיפול ופתולוגיה. יש לשים לב שהנתונים הנרכשים על שריר אחד (למשל, גסטרוקנמיוס) לא יספקו…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי קרן צ’ארלי ו- NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

