げっ歯類における in vivoおよび ex vivo 電気インピーダンス筋電視検査の実行
Summary
この記事では、げっ歯類の腓腹筋に対して in vivo(表面および針電極アレイを使用)および ex vivo (誘電体セルを使用)の電気インピーダンス筋電視を実行する方法について詳しく説明します。マウスとラットの両方でこの技術を実証し、利用可能な変更(すなわち、肥満動物、子犬)を詳述します。
Abstract
電気インピーダンス筋電図(EIM)は、筋肉組織の健康状態と疾患を評価するための前臨床試験および臨床試験で使用できる便利な技術です。EIMは、低強度で方向性に焦点を合わせた電流を、周波数の範囲(つまり、1kHz〜10MHz)にわたって対象の筋肉に印加し、結果として生じる電圧を記録することによって得られます。これらから、リアクタンス、抵抗、位相を含むいくつかの標準インピーダンス成分が得られます。切除された筋肉に対して ex vivo 測定を行う場合、組織の固有の受動的電気的特性、すなわち導電率と比誘電率も計算できます。EIMは、単純な廃用萎縮に関連して、または治療的介入の尺度として、さまざまな疾患における筋肉の変化を診断および追跡するために、動物およびヒトで広く使用されています。臨床的には、EIMは疾患の進行を経時的に追跡し、治療的介入の影響を評価する可能性を提供するため、臨床試験期間を短縮し、サンプルサイズの要件を減らす機会を提供します。EIMは、ヒトだけでなく生きた動物モデルでも非侵襲的または低侵襲的に実行できるため、前臨床開発と臨床開発の両方を可能にする新しいトランスレーショナルツールとして機能する可能性を提供します。この記事では、子犬や肥満動物での使用など、特定の条件に技術を適応させるためのアプローチを含む、マウスとラットで in vivoおよび ex vivo EIM測定を実行する方法について段階的に説明します。
Introduction
電気インピーダンス筋電視(EIM)は、筋肉の状態を評価するための強力な方法を提供し、神経筋障害の診断、疾患の進行の追跡、および治療に対する反応の評価を可能にする可能性があります1,2,3。動物の疾患モデルやヒトと同様に適用できるため、前臨床から臨床試験への比較的シームレスな翻訳が可能です。EIM測定は、直線的に配置された4つの電極を使用して簡単に得られ、外側の2つの電極は周波数範囲(一般に1kHzから約2MHz)にわたって痛みのない弱い電流を流し、内側の2つの電極は結果として生じる電圧を記録します1。これらの電圧から、抵抗(R)、電流が組織を通過するのがどれほど難しいかの尺度、および組織のリアクタンス(X)または「帯電性」(電荷を蓄積する組織の能力(静電容量)に関連する尺度)を含む、組織のインピーダンス特性を得ることができます。リアクタンスと抵抗から、位相角(θ)は次式で計算されます。 は、単一の総和インピーダンス測定値を提供します。 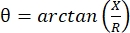 このような測定値は、任意の多周波生体インピーダンスデバイスを用いて得ることができる。筋線維は本質的に長い円柱であるため、筋肉組織も異方性が高く、線維を横切るよりも線維に沿って電流が流れやすくなります4,5。したがって、EIMはしばしば2つの方向で実行されます:電流がファイバーと平行になるようにファイバーに沿って配置されたアレイと、電流がそれらに垂直に流れるように筋肉を横切って配置されます。さらに、インピーダンス測定セル内で既知の体積の組織が測定されるex vivo測定では、筋肉の固有の電気的特性(すなわち、導電率および比誘電率)を導出することができる6。
このような測定値は、任意の多周波生体インピーダンスデバイスを用いて得ることができる。筋線維は本質的に長い円柱であるため、筋肉組織も異方性が高く、線維を横切るよりも線維に沿って電流が流れやすくなります4,5。したがって、EIMはしばしば2つの方向で実行されます:電流がファイバーと平行になるようにファイバーに沿って配置されたアレイと、電流がそれらに垂直に流れるように筋肉を横切って配置されます。さらに、インピーダンス測定セル内で既知の体積の組織が測定されるex vivo測定では、筋肉の固有の電気的特性(すなわち、導電率および比誘電率)を導出することができる6。
「神経筋障害」という用語は、構造的な筋肉の変化および機能障害につながる広範囲の原発性および二次性疾患を定義する。これには、筋萎縮性側索硬化症および様々な形態の筋ジストロフィー、ならびに老化に関連するより単純な変化(例えば、サルコペニア)、廃用性萎縮(例えば、長時間のベッドレストまたは微小重力による)、さらには傷害が含まれる7。原因は豊富であり、運動ニューロン、神経、神経筋接合部、または筋肉自体に起因する可能性がありますが、EIMを使用して、これらのプロセスの多くによる筋肉の初期の変化を検出し、進行または治療への反応を追跡できます。例えば、デュシェンヌ型筋ジストロフィー(DMD)の患者では、EIMは疾患の進行およびコルチコステロイドに対する反応を検出することが示されている8。最近の研究では、EIMは、月や火星で経験するような分数重力9や、老化の影響10,11など、さまざまな廃用状態に敏感であることも示されています。最後に、各測定で得られたデータセット(多周波および方向依存データ)に予測および機械学習アルゴリズムを適用することにより、筋線維サイズ12,13、炎症性変化および浮腫14、結合組織および脂肪含量15,16を含む組織の組織学的側面を推測することが可能になる。
針筋電図17および磁気共鳴画像法、コンピュータ断層撮影、および超音波18,19などの画像技術を含む、ヒトおよび動物の筋肉の健康を評価するために、他のいくつかの非侵襲的または低侵襲的方法も使用される。ただし、EIM は、これらのテクノロジーと比較して明確な利点を示しています。たとえば、筋電図検査は筋線維膜の能動的電気的特性のみを記録し、受動的特性は記録しないため、筋肉の構成や構造の真の評価を提供することはできません。ある点では、イメージング法は組織の構造と組成に関する情報も提供するため、EIMとより密接に関連しています。しかし、ある意味では、それらはあまりにも多くのデータを提供し、定量的な出力を提供するだけでなく、詳細な画像セグメンテーションと専門家による分析を必要とします。さらに、その複雑さを考えると、イメージング技術は、使用されているハードウェアとソフトウェアの両方の仕様によっても大きく影響され、理想的には、データセットを比較できるように同一のシステムを使用する必要があります。対照的に、EIM がはるかに単純であるという事実は、 EIM がこれらの技術的問題による影響が少なく、いかなる形式の画像処理や専門家による分析も必要としないことを意味します。
以下のプロトコルは、非侵襲的(表面アレイ)および低侵襲的(皮下ニードルアレイ)技術の両方を使用して、ラットおよびマウスで in vivo EIMを実行する方法、および切除したばかりの筋肉に対する ex vivo EIMを実行する方法を示しています。
Protocol
Representative Results
Discussion
この記事では、 インビ ボと エキソビボの両方でげっ歯類でEIMを実行するための基本的な方法について説明します。信頼性の高い測定値を取得するには、一連のステップを実行することが重要です。まず、各筋肉は病気、治療、および病理に対して異なる反応を示すため、関心のある筋肉を適切に特定する必要があります。ある筋肉(腓腹筋など)で取得したデータは、別の筋肉(?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作業は、チャーリーズ基金とNIH R01NS055099の支援を受けました。
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

