In vivo en ex vivo elektrische impedantiemyografie uitvoeren bij knaagdieren
Summary
Dit artikel beschrijft hoe in vivo (met behulp van oppervlakte- en naaldelektrodearrays) en ex vivo (met behulp van een diëlektrische cel) elektrische impedantiemyografie op de gastrocnemiusspier van knaagdieren kan worden uitgevoerd. Het zal de techniek demonstreren bij zowel muizen als ratten en de beschikbare modificaties (d.w.z. zwaarlijvige dieren, pups) beschrijven.
Abstract
Elektrische impedantiemyografie (EIM) is een handige techniek die kan worden gebruikt in preklinische en klinische studies om de gezondheid en ziekte van spierweefsel te beoordelen. EIM wordt verkregen door een lage intensiteit, richtingsgerichte, elektrische stroom toe te passen op een spier van belang over een reeks frequenties (d.w.z. van 1 kHz tot 10 MHz) en de resulterende spanningen te registreren. Hieruit worden verschillende standaard impedantiecomponenten verkregen, waaronder de reactantie, weerstand en fase. Bij het uitvoeren van ex vivo metingen aan uitgesneden spieren kunnen ook de inherente passieve elektrische eigenschappen van het weefsel, namelijk de geleidbaarheid en relatieve permittiviteit, worden berekend. EIM is op grote schaal gebruikt bij dieren en mensen om spierveranderingen bij een verscheidenheid aan ziekten te diagnosticeren en te volgen, in relatie tot eenvoudige atrofie van onbruik, of als een maat voor therapeutische interventie. Klinisch gezien biedt EIM het potentieel om de progressie van de ziekte in de loop van de tijd te volgen en de impact van therapeutische interventies te beoordelen, waardoor de mogelijkheid wordt geboden om de duur van het klinische onderzoek te verkorten en de vereisten voor de steekproefomvang te verminderen. Omdat het niet-invasief of minimaal invasief kan worden uitgevoerd in levende diermodellen en mensen, biedt EIM het potentieel om te dienen als een nieuw translationeel hulpmiddel dat zowel preklinische als klinische ontwikkeling mogelijk maakt. Dit artikel bevat stapsgewijze instructies voor het uitvoeren van in vivo en ex vivo EIM-metingen bij muizen en ratten, inclusief benaderingen om de technieken aan te passen aan specifieke omstandigheden, zoals voor gebruik bij pups of zwaarlijvige dieren.
Introduction
Elektrische impedantiemyografie (EIM) biedt een krachtige methode om de spierconditie te beoordelen, waardoor mogelijk de diagnose van neuromusculaire aandoeningen, het volgen van ziekteprogressie en de beoordeling van de respons op therapiemogelijk wordt 1,2,3. Het kan analoog worden toegepast op dierziektemodellen en mensen, waardoor een relatief naadloze vertaling van preklinische naar klinische studies mogelijk is. EIM-metingen kunnen eenvoudig worden verkregen met behulp van vier lineair geplaatste elektroden, waarbij de twee buitenste een pijnloze, zwakke elektrische stroom toepassen over een reeks frequenties (meestal tussen 1 kHz en ongeveer 2 MHz), en de twee binnenste de resulterende spanningen registreren1. Uit deze spanningen kunnen de impedantiekenmerken van het weefsel worden verkregen, waaronder de weerstand (R), een maat voor hoe moeilijk het is voor stroom om door het weefsel te gaan, en de reactantie (X) of “oplaadbaarheid” van het weefsel, een maat die verband houdt met het vermogen van het weefsel om lading op te slaan (capaciteit). Uit de reactantie en weerstand wordt de fasehoek (θ) berekend via de volgende vergelijking: 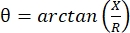 , die een enkele summatieve impedantiemaat oplevert. Dergelijke metingen kunnen worden verkregen met behulp van elk multifrequent bio-impedantie-apparaat. Omdat myofiberen in wezen lange cilinders zijn, is spierweefsel ook zeer anisotroop, waarbij stroom gemakkelijker langs vezels stroomt daneroverheen 4,5. EIM wordt dus vaak in twee richtingen uitgevoerd: met de array langs de vezels geplaatst, zodat de stroom parallel aan hen loopt, en over de spier zodat de stroom loodrecht op hen stroomt. Bovendien kunnen in ex vivo metingen, waarbij een bekend volume weefsel wordt gemeten in een impedantiemeetcel, de inherente elektrische eigenschappen van de spier (d.w.z. de geleidbaarheid en relatieve permittiviteit) worden afgeleid6.
, die een enkele summatieve impedantiemaat oplevert. Dergelijke metingen kunnen worden verkregen met behulp van elk multifrequent bio-impedantie-apparaat. Omdat myofiberen in wezen lange cilinders zijn, is spierweefsel ook zeer anisotroop, waarbij stroom gemakkelijker langs vezels stroomt daneroverheen 4,5. EIM wordt dus vaak in twee richtingen uitgevoerd: met de array langs de vezels geplaatst, zodat de stroom parallel aan hen loopt, en over de spier zodat de stroom loodrecht op hen stroomt. Bovendien kunnen in ex vivo metingen, waarbij een bekend volume weefsel wordt gemeten in een impedantiemeetcel, de inherente elektrische eigenschappen van de spier (d.w.z. de geleidbaarheid en relatieve permittiviteit) worden afgeleid6.
De term “neuromusculaire aandoeningen” definieert een breed scala aan primaire en secundaire ziekten die leiden tot structurele spierverandering en disfunctie. Dit omvat amyotrofische laterale sclerose en verschillende vormen van spierdystrofie, evenals eenvoudigere veranderingen in verband met veroudering (bijv. Sarcopenie), atrofie van het gebruik (bijvoorbeeld als gevolg van langdurig bedrust of microzwaartekracht) of zelfs letsel7. Hoewel de oorzaken overvloedig zijn en afkomstig kunnen zijn van het motorneuron, zenuwen, neuromusculaire juncties of de spier zelf, kan EIM worden gebruikt om vroege veranderingen in de spieren als gevolg van veel van deze processen te detecteren en om progressie of reactie op therapie te volgen. Bij patiënten met Duchenne spierdystrofie (DMD) is bijvoorbeeld aangetoond dat EIM ziekteprogressie en respons op corticosteroïden detecteert8. Recent werk heeft ook aangetoond dat EIM gevoelig is voor verschillende onbruiktoestanden, waaronder fractionele zwaartekracht9, zoals zou worden ervaren op de maan of Mars, en de effecten van veroudering10,11. Ten slotte, door voorspellende en machine learning-algoritmen toe te passen op de dataset die bij elke meting wordt verkregen (multifrequentie en richtingsafhankelijke gegevens), wordt het mogelijk om histologische aspecten van het weefsel af te leiden, waaronder myofibergrootte 12,13, ontstekingsveranderingen en oedeem14, en bindweefsel en vetgehalte15,16.
Verschillende andere niet-invasieve of minimaal invasieve methoden worden ook gebruikt om de spiergezondheid bij mens en dier te evalueren, waaronder naaldelektromyografie17 en beeldvormingstechnologieën zoals magnetische resonantiebeeldvorming, computertomografie en echografie 18,19. EIM laat echter duidelijke voordelen zien in vergelijking met deze technologieën. Elektromyografie registreert bijvoorbeeld alleen de actieve elektrische eigenschappen van de myofibermembranen en niet de passieve eigenschappen, en kan dus geen echte beoordeling van de spiersamenstelling of -structuur geven. In een bepaald opzicht zijn beeldvormingsmethoden nauwer verwant aan EIM, omdat ook zij informatie geven over de structuur en samenstelling van weefsel. Maar in zekere zin bieden ze te veel gegevens, waardoor gedetailleerde beeldsegmentatie en deskundige analyse nodig zijn in plaats van alleen een kwantitatieve output te leveren. Bovendien worden beeldvormingstechnieken, gezien hun complexiteit, ook sterk beïnvloed door de specifieke kenmerken van zowel de hardware als de software die wordt gebruikt, idealiter het gebruik van identieke systemen vereisen, zodat datasets kunnen worden vergeleken. Het feit dat EIM veel eenvoudiger is, betekent daarentegen dat het minder wordt beïnvloed door deze technische problemen en geen enkele vorm van beeldverwerking of deskundige analyse vereist.
Het volgende protocol demonstreert hoe in vivo EIM bij ratten en muizen kan worden uitgevoerd, met behulp van zowel niet-invasieve (surface array) als minimaal invasieve (subdermale naaldarray) technieken, evenals ex vivo EIM op vers weggesneden spieren.
Protocol
Representative Results
Discussion
Dit artikel biedt de basismethoden voor het uitvoeren van EIM bij knaagdieren, zowel in vivo als ex vivo. Om betrouwbare metingen te verkrijgen, is het van cruciaal belang om een reeks stappen uit te voeren. Ten eerste moet men de spier van belang goed identificeren, omdat elke spier verschillende reacties op ziekten, behandeling en pathologie zal hebben. Men moet er rekening mee houden dat de gegevens die zijn verkregen over één spier (bijv. Gastrocnemius) niet dezelfde informatie zullen opleveren al…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door Charley’s Fund en NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

