Esecuzione della miografia ad impedenza elettrica in vivo ed ex vivo nei roditori
Summary
Questo articolo descrive in dettaglio come eseguire la miografia ad impedenza elettrica in vivo (utilizzando array di elettrodi di superficie e ad ago) ed ex vivo (utilizzando una cella dielettrica) sul muscolo gastrocnemio dei roditori. Dimostrerà la tecnica sia nei topi che nei ratti e dettaglierà le modifiche disponibili (cioè animali obesi, cuccioli).
Abstract
La miografia ad impedenza elettrica (EIM) è una tecnica conveniente che può essere utilizzata in studi preclinici e clinici per valutare la salute e la malattia del tessuto muscolare. L’EIM si ottiene applicando una corrente elettrica a bassa intensità, focalizzata direzionalmente, a un muscolo di interesse attraverso una gamma di frequenze (cioè da 1 kHz a 10 MHz) e registrando le tensioni risultanti. Da questi, si ottengono diversi componenti di impedenza standard, tra cui la reattanza, la resistenza e la fase. Quando si eseguono misurazioni ex vivo sul muscolo asportato, è possibile calcolare anche le proprietà elettriche passive intrinseche del tessuto, vale a dire la conducibilità e la permittività relativa. L’EIM è stato ampiamente utilizzato negli animali e nell’uomo per diagnosticare e monitorare le alterazioni muscolari in una varietà di malattie, in relazione alla semplice atrofia da disuso o come misura di intervento terapeutico. Dal punto di vista clinico, l’EIM offre il potenziale per monitorare la progressione della malattia nel tempo e valutare l’impatto degli interventi terapeutici, offrendo così l’opportunità di abbreviare la durata della sperimentazione clinica e ridurre i requisiti di dimensione del campione. Poiché può essere eseguito in modo non invasivo o minimamente invasivo in modelli animali viventi e nell’uomo, EIM offre il potenziale per fungere da nuovo strumento traslazionale che consente sia lo sviluppo preclinico che clinico. Questo articolo fornisce istruzioni dettagliate su come eseguire misurazioni EIM in vivo ed ex vivo in topi e ratti, compresi gli approcci per adattare le tecniche a condizioni specifiche, come per l’uso in cuccioli o animali obesi.
Introduction
La miografia ad impedenza elettrica (EIM) fornisce un potente metodo per valutare le condizioni muscolari, consentendo potenzialmente la diagnosi di disturbi neuromuscolari, il monitoraggio della progressione della malattia e la valutazione della risposta alla terapia 1,2,3. Può essere applicato analogamente ai modelli di malattie animali e agli esseri umani, consentendo una traduzione relativamente fluida dagli studi preclinici a quelli clinici. Le misure EIM sono facilmente ottenute utilizzando quattro elettrodi posizionati linearmente, con i due esterni che applicano una corrente elettrica indolore e debole su un intervallo di frequenze (generalmente tra 1 kHz e circa 2 MHz), e i due interni che registrano le tensioni risultanti1. Da queste tensioni si possono ottenere le caratteristiche di impedenza del tessuto, tra cui la resistenza (R), una misura di quanto sia difficile per la corrente passare attraverso il tessuto, e la reattanza (X) o “caricabilità” del tessuto, una misura correlata alla capacità del tessuto di immagazzinare carica (capacità). Dalla reattanza e dalla resistenza, l’angolo di fase (θ) viene calcolato tramite la seguente equazione: 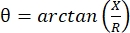 , fornendo una singola misura sommativa dell’impedenza. Tali misurazioni possono essere ottenute utilizzando qualsiasi dispositivo di bioimpedenza multifrequenza. Poiché le miofibre sono essenzialmente cilindri lunghi, il tessuto muscolare è anche altamente anisotropo, con la corrente che scorre più facilmente lungo le fibre che attraverso di esse 4,5. Pertanto, l’EIM viene spesso eseguito in due direzioni: con l’array posizionato lungo le fibre in modo tale che la corrente scorra parallela a loro e attraverso il muscolo in modo tale che la corrente fluisca perpendicolarmente a loro. Inoltre, nelle misurazioni ex vivo, in cui un volume noto di tessuto viene misurato in una cella di misurazione dell’impedenza, è possibile derivare le proprietà elettriche intrinseche del muscolo (cioè la conducibilità e la permittività relativa)6.
, fornendo una singola misura sommativa dell’impedenza. Tali misurazioni possono essere ottenute utilizzando qualsiasi dispositivo di bioimpedenza multifrequenza. Poiché le miofibre sono essenzialmente cilindri lunghi, il tessuto muscolare è anche altamente anisotropo, con la corrente che scorre più facilmente lungo le fibre che attraverso di esse 4,5. Pertanto, l’EIM viene spesso eseguito in due direzioni: con l’array posizionato lungo le fibre in modo tale che la corrente scorra parallela a loro e attraverso il muscolo in modo tale che la corrente fluisca perpendicolarmente a loro. Inoltre, nelle misurazioni ex vivo, in cui un volume noto di tessuto viene misurato in una cella di misurazione dell’impedenza, è possibile derivare le proprietà elettriche intrinseche del muscolo (cioè la conducibilità e la permittività relativa)6.
Il termine “disturbi neuromuscolari” definisce una vasta gamma di malattie primarie e secondarie che portano ad alterazioni e disfunzioni muscolari strutturali. Ciò include la sclerosi laterale amiotrofica e varie forme di distrofia muscolare, nonché cambiamenti più semplici legati all’invecchiamento (ad esempio, sarcopenia), atrofia da disuso (ad esempio, a causa di riposo a letto prolungato o microgravità) o persino lesioni7. Mentre le cause sono abbondanti e possono provenire dal motoneurone, dai nervi, dalle giunzioni neuromuscolari o dal muscolo stesso, l’EIM può essere utilizzato per rilevare alterazioni precoci nel muscolo a causa di molti di questi processi e per monitorare la progressione o la risposta alla terapia. Ad esempio, nei pazienti con distrofia muscolare di Duchenne (DMD), l’EIM ha dimostrato di rilevare la progressione della malattia e la risposta ai corticosteroidi8. Recenti lavori hanno anche dimostrato che l’EIM è sensibile ai vari stati di disuso, tra cui la gravità frazionaria9, come si sperimenterebbe sulla Luna o su Marte, e gli effetti dell’invecchiamento10,11. Infine, applicando algoritmi predittivi e di machine learning al set di dati ottenuti con ogni misurazione (dati multifrequenza e direzionalmente dipendenti), diventa possibile dedurre aspetti istologici del tessuto, tra cui la dimensione della miofibra 12,13, le alterazioni infiammatorie e l’edema 14, e il tessuto connettivo e il contenuto di grasso 15,16.
Diversi altri metodi non invasivi o minimamente invasivi sono utilizzati anche per valutare la salute muscolare negli esseri umani e negli animali, tra cui l’elettromiografia con ago17 e tecnologie di imaging come la risonanza magnetica, la tomografia computerizzata e gli ultrasuoni18,19. Tuttavia, EIM dimostra vantaggi distinti rispetto a queste tecnologie. Ad esempio, l’elettromiografia registra solo le proprietà elettriche attive delle membrane miofibre e non le proprietà passive, e quindi non può fornire una vera valutazione della composizione o della struttura muscolare. In un certo senso, i metodi di imaging sono più strettamente correlati all’EIM, in quanto anch’essi forniscono informazioni sulla struttura e la composizione del tessuto. Ma in un certo senso, forniscono troppi dati, richiedendo una segmentazione dettagliata delle immagini e un’analisi di esperti piuttosto che fornire solo un output quantitativo. Inoltre, data la loro complessità, le tecniche di imaging sono anche fortemente influenzate dalle specifiche sia dell’hardware che del software utilizzati, idealmente richiedendo l’uso di sistemi identici in modo che i set di dati possano essere confrontati. Al contrario, il fatto che EIM sia molto più semplice significa che è meno influenzato da questi problemi tecnici e non richiede alcuna forma di elaborazione delle immagini o analisi di esperti.
Il seguente protocollo dimostra come eseguire EIM in vivo in ratti e topi, utilizzando tecniche non invasive (array di superficie) e minimamente invasive (array di aghi subdermici), nonché EIM ex vivo su muscoli appena asportati.
Protocol
Representative Results
Discussion
Questo articolo fornisce i metodi di base per eseguire EIM nei roditori, sia in vivo che ex vivo. Per acquisire misurazioni affidabili, è fondamentale eseguire una serie di passaggi. In primo luogo, è necessario identificare correttamente il muscolo di interesse, poiché ogni muscolo avrà risposte diverse a malattie, trattamenti e patologie. Bisogna essere consapevoli che i dati acquisiti su un muscolo (ad esempio, gastrocnemio) non forniranno le stesse informazioni di un altro muscolo (ad esempio, t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto da Charley’s Fund e NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
References
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

