Cel-Lineage geleide massaspectrometrie proteomics in het zich ontwikkelende (kikker) embryo
Summary
Hier beschrijven we een op massaspectrometrie gebaseerde proteomische karakterisering van cellijnen met bekende weefsellotgevallen in het gewervelde Xenopus laevis-embryo .
Abstract
Karakterisering van moleculaire gebeurtenissen als cellen aanleiding geven tot weefsels en organen verhoogt een potentieel om de normale ontwikkeling beter te begrijpen en efficiënte remedies voor ziekten te ontwerpen. Technologieën die een nauwkeurige identificatie en kwantificering van verschillende soorten en grote aantallen eiwitten mogelijk maken, zouden nog steeds ontbrekende informatie opleveren over moleculaire mechanismen die de ontwikkeling van weefsels en organismen in ruimte en tijd orkestreren. Hier presenteren we een op massaspectrometrie gebaseerd protocol dat de meting van duizenden eiwitten in geïdentificeerde cellijnen in Xenopus laevis (kikker) embryo’s mogelijk maakt. De aanpak bouwt voort op reproduceerbare cel-lotkaarten en gevestigde methoden om cellen en hun nakomelingen (klonen) te identificeren, fluorescerend te labelen, te volgen en te bemonsteren vanuit dit model van gewervelde ontwikkeling. Na het verzamelen van cellulaire inhoud met behulp van microsampling of het isoleren van cellen door dissectie of fluorescentie-geactiveerde celsortering, worden eiwitten geëxtraheerd en verwerkt voor bottom-up proteomische analyse. Vloeistofchromatografie en capillaire elektroforese worden gebruikt om schaalbare scheiding te bieden voor eiwitdetectie en kwantificering met hoge resolutie massaspectrometrie (HRMS). Representatieve voorbeelden worden gegeven voor de proteomische karakterisering van neurale weefselvette cellen. Cel-lineage-geleide HRMS proteomics is aanpasbaar aan verschillende weefsels en organismen. Het is voldoende gevoelig, specifiek en kwantitatief om in de spatio-temporele dynamiek van het proteoom te kijken tijdens de ontwikkeling van gewervelde dieren.
Introduction
Ons begrip van celdifferentiatie en het ontstaan van weefsels en organen is het resultaat van tientallen jaren van uitgebreide gerichte screenings van genen en hun producten. Het vergroten van onze kennis van alle biomoleculen en hun hoeveelheden tijdens belangrijke cellulaire gebeurtenissen zou helpen bij het ontrafelen van moleculaire mechanismen die de ruimtelijke en temporele patronen van het gewervelde lichaamsplan beheersen. Technologieën die moleculaire amplificatie en sequencing mogelijk maken, zijn nu in staat om routinematig te rapporteren over grote aantallen genen en transcripten, ter ondersteuning van hypothesegestuurde studies in fundamenteel biologisch en translationeel onderzoek. Om ontwikkelende systemen te begrijpen, pleit een complexe relatie tussen transcriptie en translatie voor directe analyse van meerdere eiwitten en hun posttranslationele modificaties. Globale proteomics met behulp van in vitro biologische systemen, zoals geïnduceerde pluripotente stamcellen, begonnen mechanismen van weefselinductieaf te bakenen 1,2. In complexe organismen, zoals het gewervelde embryo, is de ontwikkeling afhankelijk van morfogene gradiënten in de context van ruimte en tijd3. Hieruit volgt dat het verkrijgen van kennis van proteomische veranderingen naarmate cellen differentiëren om gespecialiseerde weefsels te vormen, zoals neurale weefsels, een sleutel biedt om moleculaire programma’s te ontgrendelen die de normale en defecte ontwikkeling beheersen en therapieën van de volgende generatie begeleiden.
De gewervelde Zuid-Afrikaanse klauwkikker (Xenopus laevis) is een beproefd model in de cel- en ontwikkelings-, neuro- en regeneratieve biologie. Sir John Gurdon’s 2012 Nobelprijs voor de Fysiologie of Geneeskunde 4,5 voor de ontdekking van pluripotentie van de somatische kern benadrukte het belang van dit model voor ontdekkingen in fundamentele en translationele studies. Xenopus-embryo’s ontwikkelen zich extern voor de moeder, waardoor directe manipulatie van cellen, celklonen en genexpressie over verschillende stadia van ontwikkeling mogelijk wordt. Asymmetrische pigmentatie en stereotiepe celdelingen maakten het mogelijk om reproduceerbare lotkaarten van het 16-6 en 32-cel 7,8 stadium embryo in kaart te brengen. Voor op hoge resolutie massaspectrometrie (HRMS) gebaseerde proteomics zijn bijkomende voordelen van het model een relatief grote omvang (~ 1 mm in diameter), die een overvloedig eiwitgehalte oplevert voor analyse (~ 130 μg in embryo’s in het vroege splitsingsstadium, ~ 10 μg eiwitgehalte in enkele cellen van het 16-celembryo)9,10.
Op dit moment is HRMS de toonaangevende technologie bij uitstek voor het detecteren van eiwitten. Deze technologie maakt directe, gevoelige en specifieke detectie en kwantificering van meerdere, meestal honderden tot duizenden verschillende eiwittenmogelijk 11. Bottom-up proteomics door HRMS omvat een reeks onderling verbonden stappen. Na extractie uit het cel/weefselmonster worden eiwitten verteerd met een proteolytisch enzym, zoals trypsine (bottom-up proteomics). De resulterende peptiden worden gescheiden op basis van hun verschillende fysisch-chemische eigenschappen, waaronder hydrofobiciteit (reversed-phase vloeistofchromatografie, LC), nettolading (ionenwisselingschromatografie), grootte (grootte-uitsluitingschromatografie) of elektroforetische mobiliteit (capillaire elektroforese, CE). Peptiden worden vervolgens geladen (geïoniseerd), meestal met behulp van elektrospray-ionisatie (ESI), en peptide-ionen worden gedetecteerd en gesequenced via gasfasefragmentatie door tandem HRMS. De resulterende peptidegegevens worden toegewezen aan het proteoom van het organisme dat wordt bestudeerd. Met eiwitspecifieke (proteotypische) peptide-ionsignaalintensiteit die correleert met concentratie, kan eiwitkwantificering labelvrij of labelgebaseerd (multiplexingkwantificering) worden uitgevoerd. HRMS-proteomics levert een rijke bron van informatie op over de moleculaire toestand van het bestudeerde systeem, waardoor hypothesen kunnen worden gegenereerd en functionele vervolgstudies kunnen worden uitgevoerd.
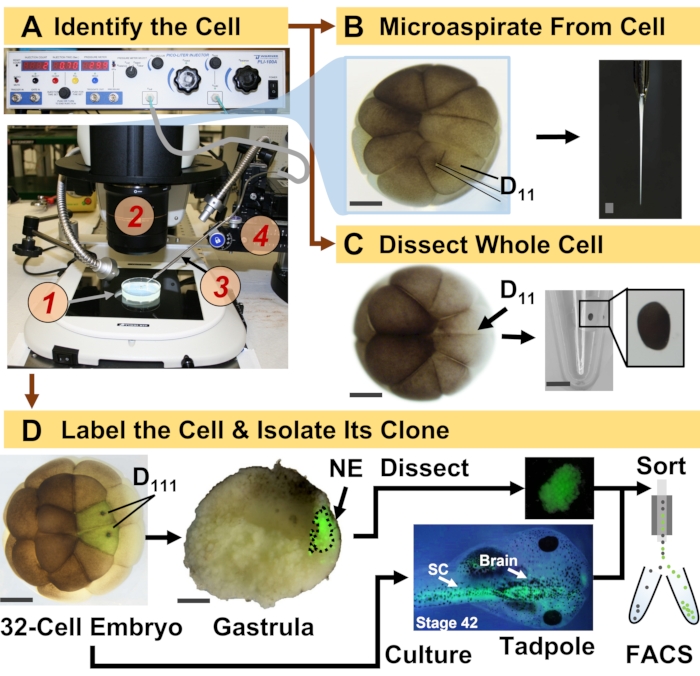
Figuur 1: Spatiotemporaal schaalbare proteomics die cel-afstamming geleide HRMS proteomics in het zich ontwikkelende (kikker) embryo mogelijk maken. (A) Visualisatie van het monster (1) met behulp van een stereomicroscoop (2) voor injectie van een geïdentificeerde cel (inzet), met behulp van een gefabriceerde micropipette (3) onder controle door een translatiestadium (4). B) Subcellulaire bemonstering van de geïdentificeerde linker D11-cel in een embryo met 16 cellen. (C) Dissectie van een hele D11-cel uit een embryo van 16 cellen. (D) Fluorescerende (groene) tracering van de linker en rechter D111 nakomelingen van een 32-celig embryo om dissectie van het neurale ectoderm (NE) in de gastrula (stadium 10) en isolatie van het afstammelingsweefsel van het kikkervisje met behulp van FACS te begeleiden. Schaalstaven: 200 μm voor embryo’s, 1,25 mm voor de injectieflacon. De cijfers werden met toestemming aangepast van referenties 15,19,21,59. Klik hier om een grotere versie van deze figuur te bekijken.
Het hier gepresenteerde protocol maakt hrms-gebaseerde kwantificering mogelijk van grote aantallen eiwitten in geïdentificeerde cellen / weefsels bij het ontwikkelen van X. laevis-embryo’s. De aanpak bouwt voort op nauwkeurige celidentificatie, reproduceerbare cellotkaarten en gevestigde methodologieën om cellijnen te volgen in dit biologische model 6,7,8. Zoals te zien is in figuur 1, bestuderen we proteomen van afzonderlijke cellen door gebruik te maken van hele-celdissectie of capillaire microsampling om cellulaire inhoud te aspirateren. Het monitoren van de afstamming van een cel stelt ons in staat om de spatiotemporale evolutie van het proteoom te bestuderen als cellen weefsels vormen tijdens gastrulatie. Het celprogenaat wordt fluorescerend gemarkeerd door het injecteren van een fluorofoor geconjugeerd aan inert dextran of mRNA voor fluorescerend eiwit (bijv. Groen fluorescerend eiwit of GFP). Het gelabelde nageslacht wordt geïsoleerd op de gewenste ontwikkelingstijdstippen. Tijdens gastrulatie kunnen celklonen die strak geclusterd zijn, worden geïsoleerd door dissectie. Na gastrulatie kunnen celklonen in het embryo worden verspreid als gevolg van migratiebewegingen en kunnen ze worden geïsoleerd uit gedissocieerde weefsels door fluorescentie-geactiveerde celsortering (FACS). Eiwitten in deze cellen en weefsels worden gemeten via bottom-up proteomics met HPLC of CE voor scheiding en ESI tandem HRMS voor identificatie. Cel-lineage-geleide HRMS proteomics is schaalbaar naar verschillende celgroottes en afstammingslijnen binnen het embryo en is specifiek, gevoelig en kwantitatief. Aan de hand van geselecteerde voorbeelden die hier worden getoond, laten we ook zien dat dit protocol schaalbaar en breed aanpasbaar is aan verschillende soorten cellen en cellijnen.
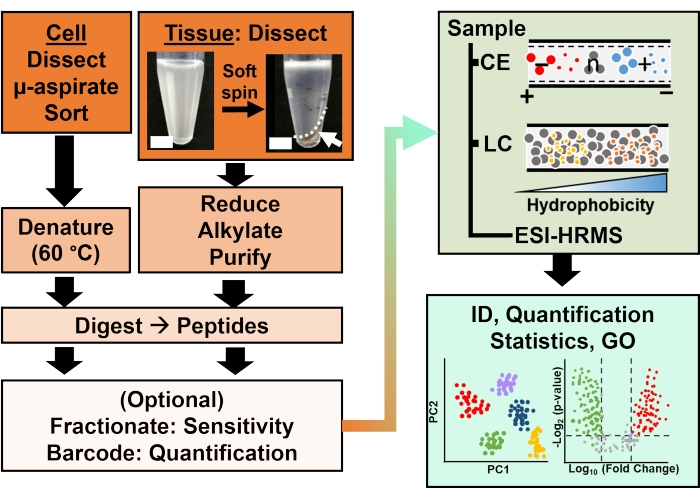
Figuur 2: De bioanalytische workflow. Microdissectie en capillaire aspiratie, of FACS, vergemakkelijkten de bemonstering van cellulair en klonaal eiwitgehalte. Uitputting van overvloedige dooiereiwitten en scheiding door capillaire elektroforese (CE) of nano-flow vloeistofchromatografie (LC) verbeterde identificatie (ID) gevoeligheid met behulp van elektrospray ionisatie (ESI) hoge resolutie massaspectrometrie (HRMS). Kwantificering onthulde ontregeling en leverde nieuwe informatie op voor hypothese-gedreven studies in combinatie met informatie die beschikbaar was via genontologie (GO). De cijfers zijn met toestemming aangepast aan referentie15. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Dit protocol maakt de karakterisering van eiwitexpressie in geïdentificeerde cellijnen in embryo’s van de Xenopus-soort mogelijk. Voortkomend uit HRMS, combineert de methodologie voortreffelijke specificiteit in moleculaire identificatie, vermogen voor multi-eiwitdetectie zonder moleculaire sondes (meestal honderden tot duizenden verschillende eiwitten) en een vermogen tot kwantificering. Aanpassingsvermogen aan klassieke hulpmiddelen en workflows in cel- en ontwikkelingsbiologie (neuro)biologie breiden HRMS-pr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We zijn Jie Li (University of Maryland, College Park) dankbaar voor waardevolle discussies over embryonale dissociatie en FACS. We danken Vi M. Quach en Camille Lombard-Banek voor hun hulp bij de voorbereiding van monsters en het verzamelen van gegevens in eerdere studies die een voorbeeld zijn van de proteomische toepassingen die in dit protocol worden benadrukt. Delen van dit werk werden ondersteund door de National Science Foundation onder toekenningsnummer IOS-1832968 CAREER (aan P.N.), de National Institutes of Health onder toekenningsnummer R35GM124755 (aan P.N.), de University of Maryland-National Cancer Institute Partnership Program (aan P.N.), en COSMOS Club Foundation onderzoeksprijzen (aan A.B.B. en L.R.P.).
Materials
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Agarose | ThermoFisher Scientific | R0492 | |
| Ammonium bicarbonate | Fisher Scientific | A643-500 | |
| Analytical Column | Thermo Scientific | 164941 | |
| Analytical microbalance | Mettler-Toledo | XSE105DU | |
| Automatic peptide fractionation platform | Agilent | 1260 Infinity II | |
| Borosilicate Capillaries | Sutter Instruments Co. | B100-50-10 | |
| Borosilicate Capillaries (for making Emmitters) | Sutter Instruments | B100-75-10 | |
| C18 spin columns (for desalting) | ThermoFisher Scientific | 89870 | |
| Camera ro monitor electrospray | Edmund Optics Inc. | EO-2018C | |
| Combretastatin A4 | Millipore Sigma | C7744 | |
| Commercial CESI system | AB SCIEX | CESI | |
| (Cyclohexylamino)-1-propanesulfonic acid (CAPS) | VWR | 97061-492 | |
| Cytochalasin D | Millipore Sigma | C8273 | |
| Dextran, Alexa Fluor 488; 10,000 MW, Anionic, Fixable | ThermoFisher Scientific | D22910 | |
| Diothiothreitol | Fisher Scientific | FERR0861 | |
| Dumont #5 Forceps | Fine Science Tools | 11252-30 | |
| EDTA | Fisher Scientific | AAJ62786AP | |
| Epifluorescence light source | Lumencore | AURA III | |
| Eppendorf LoBing microcentrifuge tubes: protein | Fisher Scientific | 13-698-793 | |
| Formic acid (LC-MS-grade) | Fisher Scientific | A117-50 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Thermo Scientific | TSX40086A | |
| Fused silica capillary | Molex | 1088150596 | |
| Heat Block | Benchmark | BSH300 | |
| High pressure liquid Chromatography System | ThermoFisher Scientific | Dionex Ultimate 3000 RSLC nanosystem | |
| High voltage power supply | Spellman | CZE1000R | |
| High-resolution Mass Spectrometer | ThermoFisher Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | |
| HPLC caps | Thermo Scientific | C4013-40A | |
| HPLC Vials | Thermo Scientific | C4013-11 | |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide | Fisher Scientific | AC122275000 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Microcapillary puller | Suttor Instruments | P-2000 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Micropippette puller | Sutter Instruments Co. | P-1000 | |
| MS data analysis software, commercial | ProteomeDiscoverer | ||
| MS data analysis software, opensource | MaxQuant | ||
| non-idet 40 substitute | Millipore Sigma | 11754599001 | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Pierce 10 µL bed Zip-tips (for desalting) | ThermoFisher Scientific | 87782 | |
| Pierce bicinchoninic acid protein assay kit | ThermoFisher Scientific | 23225 | |
| Pierce quantitative colorimetric peptide assay | ThermoFisher Scientific | 23275 | |
| Pierce Trypsin Protease (MS Grade) | Fisher Scientific | PI90058 | |
| Protein LoBind vials | Eppendorf | 0030108434 , 0030108442 |
|
| Refrigerated Centrifuge | Eppendorf | 5430R | |
| Refrigerated Incubator | Thermo Scientific | PR505755R/3721 | |
| sodium isethionate | Millipore Sigma | 220078 | |
| sodium pyrophosphate | Sigma Aldrich | 221368-100G | |
| Stainless steel BGE vial | Custom-Built | ||
| Stainless steel sample vials | Custom-Built | ||
| Stereomicroscope (objective 10x) | Nikon | SMZ 1270, SZX18 | |
| Sucrose | VWR | 97063-790 | |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Syringes (gas-tight): 500–1000 µL | Hamilton | 1750TTL | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Trap Column | Thermo Scientific | 164750 | |
| Tris-HCl (1 M solution) | Fisher Scientific | AAJ22638AP | |
| Vacuum concentrator capable of operation at 4–10 °C | Labconco | 7310022 | |
| Vortex-mixer | Benchmark | BS-VM-1000 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-Built |
References
- Shoemaker, L. D., Kornblum, H. I. Neural Stem Cells (NSCs) and Proteomics. Molecular & Cellular Proteomics. 15 (2), 344-354 (2016).
- Cervenka, J., et al. Proteomic characterization of human neural stem cells and their secretome during in vitro differentiation. Frontiers in Cellular Neuroscience. 14, 612560 (2021).
- Christian, J. L. Morphogen gradients in development: From form to function. Wiley Interdisciplinary Reviews. Developmental Biology. 1 (1), 3-15 (2012).
- Gurdon, J. B., Elsdale, T. R., M, F. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature. 182, 64-65 (1958).
- Harland, R. M., Grainger, R. M. Xenopus research: metamorphosed by genetics and genomics. Trends in Genetics. 27 (12), 507-515 (2011).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. 发育生物学. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell stage Xenopus embryo. 发育生物学. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Sun, L. L., et al. Single cell proteomics using frog (Xenopus laevis) blastomeres isolated from early stage embryos, which form a geometric progression in protein content. Analytical Chemistry. 88 (13), 6653-6657 (2016).
- Lombard-Banek, C., Moody, S. A., Nemes, P. Single-cell mass spectrometry for discovery proteomics: quantifying translational cell heterogeneity in the 16-cell frog (Xenopus) embryo. Angewandte Chemie-International Edition. 55 (7), 2454-2458 (2016).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
- Briggs, J. A., et al. The dynamics of gene expression in vertebrate embryogenesis at single-cell resolution. Science. 360 (6392), (2018).
- Gupta, M., Sonnett, M., Ryazanova, L., Presler, M., Wuhr, M., Vleminckx, K. Quantitative proteomics of xenopus embryos I, sample preparation. Xenopus. Methods in Molecular Biology. 1865, 175-194 (2018).
- Baxi, A. B., Lombard-Banek, C., Moody, S. A., Nemes, P. Proteomic characterization of the neural ectoderm fated cell clones in the Xenopus laevis embryo by high-resolution mass spectrometry. ACS Chemical Neuroscience. 9 (8), 2064-2073 (2018).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods in Molecular Biology. 135, 331-347 (2000).
- Sater, A. K., Moody, S. A. Using Xenopus to understand human diseases and developmental disorders. Genesis. 55 (1-2), 1-14 (2017).
- Lombard-Banek, C., Choi, S. B., Nemes, P., Allbritton, N. L., Kovarik, M. L. . Enzyme Activity in Single Cells. Methods in Enzymology. 628, 263-292 (2019).
- Lombard-Banek, C., Moody, S. A., Nemes, P. High-sensitivity mass spectrometry for probing gene translation in single embryonic cells in the early frog (Xenopus) embryo. Frontiers in Cell and Developmental Biology. 4, 11 (2016).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. Microprobe capillary electrophoresis mass spectrometry for single-cell metabolomics in live frog (Xenopus laevis) embryos. Journal of Visualized Experiments: JoVE. (130), e56956 (2017).
- Lombard-Banek, C., Moody, S. A., Manzin, M. C., Nemes, P. Microsampling capillary electrophoresis mass spectrometry enables single-cell proteomics in complex tissues: developing cell clones in live Xenopus laevis and zebrafish embryos. Analytical Chemistry. 91 (7), 4797-4805 (2019).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. 发育生物学. 120 (1), 299-304 (1987).
- Karimi, K., et al. Xenbase: a genomic, epigenomic and transcriptomic model organism database. Nucleic Acids Research. 46 (1), 861-868 (2018).
- Kakebeen, A. D., Chitsazan, A. D., Wills, A. E. Tissue disaggregation and isolation of specific cell types from transgenic Xenopus appendages for transcriptional analysis by FACS. Developmental Dynamics. 250 (9), 1381-1392 (2021).
- Garcia, B. A. What does the future hold for top down mass spectrometry. Journal of the American Society for Mass Spectrometry. 21 (2), 193-202 (2010).
- Toby, T. K., Fornelli, L., Kelleher, N. L. Progress in top-down proteomics and the analysis of proteoforms. Annual Review of Analytical Chemistry. (Palo Alto Calif). 9 (1), 499-519 (2016).
- Zhang, Z. B., Dubiak, K. M., Huber, P. W., Dovichi, N. J. Miniaturized filter-aided sample preparation (MICRO-FASP) method for high throughput, ultrasensitive proteomics sample preparation reveals proteome asymmetry in Xenopus laevis Embryos. Analytical Chemistry. 92 (7), 5554-5560 (2020).
- Wisniewski, J. R., Becher, D. . Microbial Proteomics: Methods and Protocols.Methods in Molecular Biology. 1841, 3-10 (2018).
- Hughes, C. S., et al. Single-pot, solid-phase-enhanced sample preparation for proteomics experiments. Nature Protocols. 14 (1), 68-85 (2019).
- Zhu, Y., et al. Nanodroplet processing platform for deep and quantitative proteome profiling of 10-100 mammalian cells. Nature Communications. 9, 882 (2018).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute-solution in the presence of detergents and lipids. Analytical Biochemistry. 138 (1), 141-143 (1984).
- Jiang, L., He, L., Fountoulakis, M. Comparison of protein precipitation methods for sample preparation prior to proteomic analysis. Journal of Chromatography A. 1023 (2), 317-320 (2004).
- Hildonen, S., Halvorsen, T. G., Reubsaet, L. Why less is more when generating tryptic peptides in bottom-up proteomics. Proteomics. 14 (17-18), 2031-2041 (2014).
- Budnik, B., Levy, E., Harmange, G., Slavov, N. SCoPE-MS: mass spectrometry of single mammalian cells quantifies proteome heterogeneity during cell differentiation. Genome Biology. 19, 161 (2018).
- Drouin, N., et al. Capillary electrophoresis-mass spectrometry at trial by metabo-ring: effective electrophoretic mobility for reproducible and robust compound annotation. Analytical Chemistry. 92 (20), 14103-14112 (2020).
- Sun, L. L., Zhu, G. J., Zhang, Z. B., Mou, S., Dovichi, N. J. Third-generation electrokinetically pumped sheath-flow nanospray interface with improved stability and sensitivity for automated capillary zone electrophoresis-mass spectrometry analysis of complex proteome digests. Journal of Proteome Research. 14 (5), 2312-2321 (2015).
- DeLaney, K., Sauer, C. S., Vu, N. Q., Li, L. J. Recent advances and new perspectives in capillary electrophoresis-mass spectrometry for single cell "omics". Molecules. 24 (1), 21 (2019).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nature Protocols. 8 (4), 783-799 (2013).
- Choi, S. B., Zamarbide, M., Manzini, M. C., Nemes, P. Tapered-tip capillary electrophoresis nano-electrospray ionization mass spectrometry for ultrasensitive proteomics: the mouse cortex. Journal of the American Society for Mass Spectrometry. 28 (4), 597-607 (2017).
- Pino, L. K., Rose, J., O’Broin, A., Shah, S., Schilling, B. Emerging mass spectrometry-based proteomics methodologies for novel biomedical applications. Biochemical Society Transactions. 48 (5), 1953-1966 (2020).
- Chen, C., Hou, J., Tanner, J. J., Cheng, J. L. Bioinformatics methods for mass spectrometry-based proteomics data analysis. International Journal of Molecular Sciences. 21 (8), 25 (2020).
- Peshkin, L., et al. On the relationship of protein and mRNA dynamics in vertebrate embryonic development. Developmental Cell. 35 (3), 383-394 (2015).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Gygi, S. P., et al. Quantitative analysis of complex protein mixtures using isotope-coded affinity tags. Nature Biotechnology. 17 (10), 994-999 (1999).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Analytical Chemistry. 75 (8), 1895-1904 (2003).
- Mi, H. Y., et al. PANTHER version 16: a revised family classification, tree-based classification tool, enhancer regions and extensive api. Nucleic Acids Research. 49, 394-403 (2021).
- Schmidt, E., et al. . On the Move Federated Workshops. , 710-719 (2006).
- Deutsch, E. W., et al. Trans-Proteomic pipeline, a standardized data processing pipeline for large-scale reproducible proteomics informatics. Proteomics Clinical Applications. 9 (7-8), 745-754 (2015).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Demsar, J., et al. Orange: Data mining toolbox in Python. Journal of Machine Learning Research. 14, 2349-2353 (2013).
- Oberg, A. L., Vitek, O. Statistical design of quantitative mass spectrometry-based proteomic experiments. Journal of Proteome Research. 8 (5), 2144-2156 (2009).
- Jensen, L. J., et al. STRING 8 – a global view on proteins and their functional interactions in 630 organisms. Nucleic Acids Research. 37, 412-416 (2009).
- Schweppe, D. K., Huttlin, E. L., Harper, J. W., Gygi, S. P. BioPlex display: an interactive suite for large-scale AP-MS protein-protein interaction data. Journal of Proteome Research. 17 (1), 722-726 (2018).
- Hornbeck, P. V., et al. PhosphoSitePlus, 2014: mutations, PTMs and recalibrations. Nucleic Acids Research. 43, 512-520 (2015).
- Letunic, I., Khedkar, S., Bork, P. SMART: recent updates, new developments and status in 2020. Nucleic Acids Research. 49, 458-460 (2021).
- Lombard-Banek, C., et al. In vivo subcellular mass spectrometry enables proteo-metabolomic single-cell systems biology in a chordate embryo developing to a normally behaving tadpole (X. laevis). Angewandte Chemie-International Edition. 60 (23), 12852-12858 (2021).
- Lombard-Banek, C., Reddy, S., Moody, S. A., Nemes, P. Label-free quantification of proteins in single embryonic cells with neural fate in the cleavage-stage frog (Xenopus laevis) embryo using capillary electrophoresis electrospray ionization high-resolution mass spectrometry (CE-ESI-HRMS). Molecular & Cellular Proteomics. 15 (8), 2756-2768 (2016).
- Saha-Shah, A., et al. Single cell proteomics by data-independent acquisition to study embryonic asymmetry in Xenopus laevis. Analytical Chemistry. 91 (14), 8891-8899 (2019).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Analytical Chemistry. 89 (13), 7069-7076 (2017).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).

