Gelişmekte Olan (Kurbağa) Embriyoda Hücre-Soy Kılavuzlu Kütle Spektrometrisi Proteomikleri
Summary
Burada, omurgalı Xenopus laevis embriyosunda bilinen doku kaderlerine sahip hücre soylarının kütle spektrometrisine dayalı proteomik karakterizasyonu açıklanmaktadır.
Abstract
Moleküler olayların hücreler doku ve organlara yol açtıkça karakterizasyonu, normal gelişimi daha iyi anlama ve hastalıklar için etkili ilaçlar tasarlama potansiyelini artırmaktadır. Çeşitli tiplerin ve çok sayıda proteinin doğru bir şekilde tanımlanmasını ve nicelleştirilmesini sağlayan teknolojiler, uzay ve zamanda doku ve organizma gelişimini düzenleyen moleküler mekanizmalar hakkında hala eksik bilgi sağlayacaktır. Burada, Xenopus laevis (kurbağa) embriyolarında tanımlanmış hücre soylarındaki binlerce proteinin ölçülmesini sağlayan kütle spektrometrisine dayalı bir protokol sunuyoruz. Yaklaşım, tekrarlanabilir hücre-kader haritalarına ve bu omurgalı gelişim modelinden hücreleri ve soylarını (klonlarını) tanımlamak, floresan olarak etiketlemek, izlemek ve örneklemek için yöntemler üzerine kuruludur. Diseksiyon veya floresan ile aktive edilmiş hücre sıralama ile mikro örnekleme veya izole hücreler kullanılarak hücresel içerik toplandıktan sonra, proteinler aşağıdan yukarıya proteomik analiz için ekstrakte edilir ve işlenir. Sıvı kromatografisi ve kılcal elektroforez, yüksek çözünürlüklü kütle spektrometrisi (HRMS) ile protein tespiti ve nicelleştirilmesi için ölçeklenebilir ayırma sağlamak için kullanılır. Nöral-doku kaderi olan hücrelerin proteomik karakterizasyonu için temsili örnekler verilmiştir. Hücre soy rehberliğinde HRMS proteomik, farklı doku ve organizmalara uyarlanabilir. Omurgalı gelişimi sırasında proteomun uzaysal-zamansal dinamiklerine bakmak için yeterince hassas, spesifik ve nicelikseldir.
Introduction
Hücre farklılaşması ve doku ve organların oluşumu hakkındaki anlayışımız, genlerin ve ürünlerinin onlarca yıllık ayrıntılı hedeflenmiş ekranlarının sonucudur. Önemli hücresel olaylar sırasında tüm biyomoleküller ve miktarları hakkındaki bilgimizi arttırmak, omurgalı vücut planının mekansal ve zamansal modellemesini kontrol eden moleküler mekanizmaların çözülmesine yardımcı olacaktır. Moleküler amplifikasyon ve dizilemeyi mümkün kılan teknolojiler artık çok sayıda gen ve transkript hakkında rutin olarak rapor verebilmekte ve temel biyolojik ve translasyonel araştırmalarda hipotez odaklı çalışmaları desteklemektedir. Gelişmekte olan sistemleri anlamak için, transkripsiyon ve çeviri arasındaki karmaşık bir ilişki, çoklu proteinlerin ve bunların çeviri sonrası modifikasyonlarının doğrudan analizini savunur. İndüklenmiş pluripotent kök hücreler gibi in vitro biyolojik sistemleri kullanan küresel proteomikler, doku indüksiyon mekanizmalarını tanımlamaya başladı 1,2. Omurgalı embriyosu gibi karmaşık organizmalarda gelişim, uzay ve zaman bağlamında morfojen gradyanlarına dayanır3. Hücreler sinir dokuları gibi özel dokular oluşturmak için farklılaştıkça proteomik değişiklikler hakkında bilgi edinmenin, normal ve kusurlu gelişimi kontrol eden moleküler programların kilidini açmak ve yeni nesil terapötiklere rehberlik etmek için bir anahtar sunduğu anlaşılmaktadır.
Omurgalı Güney Afrika pençeli kurbağası (Xenopus laevis), hücre ve gelişimsel, nöro ve rejeneratif biyolojide köklü bir modeldir. Sir John Gurdon’un somatik çekirdeğin pluripotensinin keşfi için 2012 Nobel Fizyoloji veya Tıp Ödülü 4,5, bu modelin temel ve translasyonel çalışmalardaki keşifler için önemini vurguladı. Xenopus embriyoları anneye dışarıdan gelişir, böylece hücrelerin, hücre klonlarının ve gen ekspresyonunun gelişimin çeşitli aşamalarında doğrudan manipülasyonunu kolaylaştırır. Asimetrik pigmentasyon ve basmakalıp hücre bölünmeleri, 16-6 ve 32 hücreli 7,8 aşamalı embriyodan tekrarlanabilir kader haritalarının çizilmesini sağladı. Yüksek çözünürlüklü kütle spektrometresi (HRMS) tabanlı proteomikler için, modelin ek avantajları, analiz için bol miktarda protein içeriği sağlayan nispeten büyük boyutu (~ 1 mm çapında) içerir (erken bölünme aşamasındaki embriyolarda ~ 130 μg, 16 hücreli embriyonun tek hücrelerinde ~ 10 μg protein içeriği)9,10.
Şu anda, HRMS, proteinleri tespit etmek için tercih edilen önde gelen teknolojidir. Bu teknoloji, çoklu, genellikle yüzlerce-binlerce farklı proteinin doğrudan, hassas ve spesifik olarak algılanmasını ve nicelleştirilmesini sağlar11. HRMS tarafından aşağıdan yukarıya proteomik, birbirine bağlı bir dizi adımı içerir. Hücre / doku örneğinden ekstraksiyonu takiben, proteinler tripsin (aşağıdan yukarıya proteomik) gibi proteolitik bir enzimle sindirilir. Elde edilen peptitler, hidrofobiklik (ters fazlı sıvı kromatografisi, LC), net yük (iyon değişim kromatografisi), boyut (boyut dışlama kromatografisi) veya elektroforetik hareketlilik (kılcal elektroforez, CE) dahil olmak üzere farklı fizikokimyasal özelliklerine göre ayrılır. Peptitler daha sonra tipik olarak elektrosprey iyonizasyonu (ESI) kullanılarak yüklenir (iyonize edilir) ve peptid iyonları tandem HRMS ile gaz fazı parçalanması yoluyla tespit edilir ve sıralanır. Elde edilen peptit verileri, incelenen organizmanın proteomu ile eşleştirilir. Proteine özgü (proteotik) peptid iyon sinyal yoğunluğu konsantrasyon ile korelasyon gösterdiğinde, protein nicelleştirmesi etiketsiz veya etiket bazlı (çoklama kantitasyonu) gerçekleştirilebilir. HRMS proteomikleri, incelenen sistemin moleküler durumu hakkında zengin bir bilgi kaynağı sunarak, hipotezlerin üretilmesine ve fonksiyonel çalışmaların izlenmesine olanak tanır.
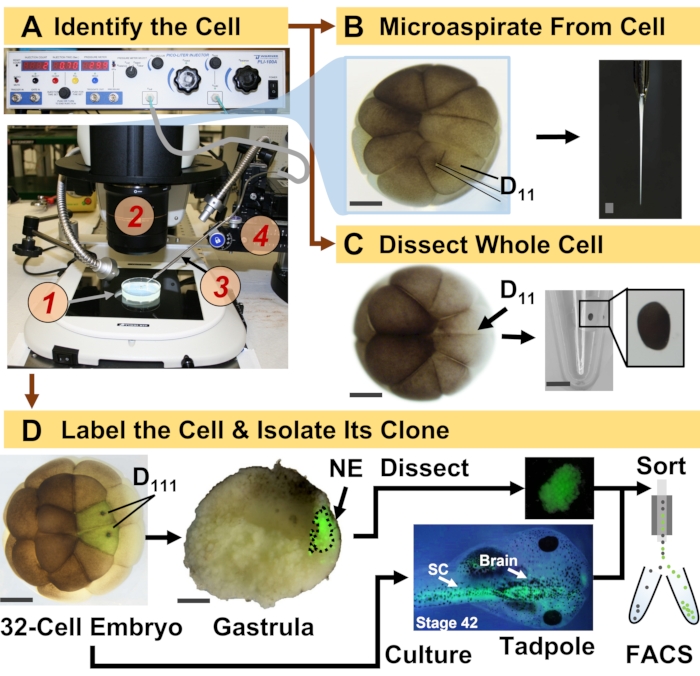
Şekil 1: Gelişmekte olan (kurbağa) embriyoda hücre-soy rehberliğinde HRMS proteomiklerini sağlayan mekansal olarak ölçeklenebilir proteomikler. (A) Numunenin (1) tanımlanmış bir hücrenin (iç kısım) enjeksiyonu için stereomikroskop (2) kullanılarak, bir çeviri aşaması (4) tarafından kontrol altında tutulan fabrikasyon bir mikropipet (3) kullanılarak görselleştirilmesi. (B) 16 hücreli bir embriyoda tanımlanan sol D11 hücresinin hücre altı örneklemesi. (C) 16 hücreli bir embriyodan bütün bir D11 hücresinin diseksiyonu. (D) Gastruladaki nöral ektodermin (NE) diseksiyonuna rehberlik etmek için 32 hücreli bir embriyodan sol ve sağ D111 döllerinin floresan (yeşil) izlenmesi (evre 10) ve FACS kullanılarak kurbağa yavrusundan inen dokunun izolasyonu. Ölçek çubukları: embriyolar için 200 μm, şişe için 1.25 mm. Rakamlar 15,19,21,59 referanslarından izin alınarak uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Burada sunulan protokol, gelişmekte olan X. laevis embriyolarında tanımlanmış hücrelerde / dokularda çok sayıda proteinin HRMS tabanlı nicelleştirilmesini sağlar. Yaklaşım, doğru hücre tanımlama, tekrarlanabilir hücre kader haritaları ve bu biyolojik model 6,7,8’deki hücre soylarını izlemek için yerleşik metodolojiler üzerine kuruludur. Şekil 1’de gösterildiği gibi, hücresel içeriği aspire etmek için tüm hücre diseksiyonu veya kılcal mikro örnekleme kullanarak tek hücrelerden proteomları inceliyoruz. Bir hücrenin soyunu izlemek, hücreler gastrulasyon sırasında dokular oluştururken proteomun uzaysal zamansal evrimini incelememize izin verir. Hücre soyunun, floresan protein (örneğin, yeşil floresan proteini veya GFP) için inert dekstran veya mRNA’ya konjuge edilmiş bir florofor enjekte edilmesiyle floresan olarak işaretlenir. Etiketli döl, istenen gelişimsel zaman noktalarında izole edilir. Gastrulasyon sırasında, sıkıca kümelenmiş hücre klonları diseksiyon ile izole edilebilir. Gastrulasyondan sonra, hücre klonları göç hareketleri nedeniyle embriyo içinde dağıtılabilir ve floresan ile aktive edilmiş hücre sıralama (FACS) ile ayrışmış dokulardan izole edilebilir. Bu hücre ve dokulardaki proteinler, ayırma için HPLC veya CE ve tanımlama için ESI tandem HRMS kullanılarak aşağıdan yukarıya proteomiklerle ölçülür. Hücre soyu rehberliğinde HRMS proteomikleri, embriyo içindeki farklı hücre boyutlarına ve soylarına ölçeklenebilir ve spesifik, hassas ve kantitatiftir. Burada gösterilen seçkin örnekler aracılığıyla, bu protokolün ölçeklenebilir olduğunu ve farklı hücre türlerine ve hücre soylarına geniş ölçüde uyarlanabileceğini de gösteriyoruz.
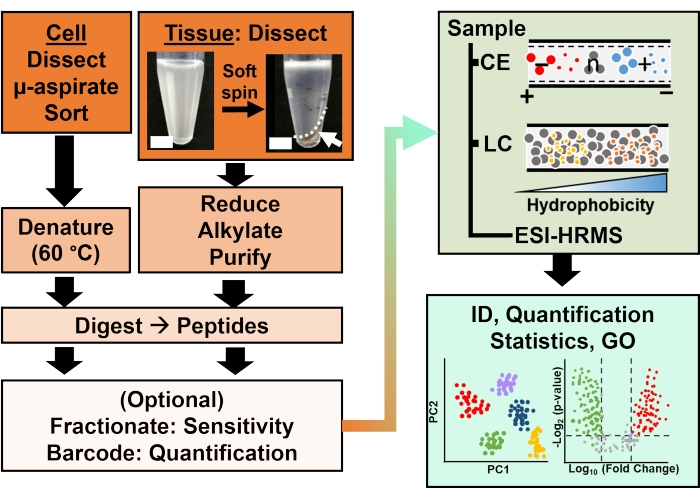
Şekil 2: Biyoanalitik iş akışı. Mikro-diseksiyon ve kılcal aspirasyon veya FACS, hücresel ve klonal protein içeriğinin örneklenmesini kolaylaştırdı. Bol miktarda yumurta sarısı proteininin tükenmesi ve kılcal elektroforez (CE) veya nano-akış sıvı kromatografisi (LC) ile ayrılması, elektrosprey iyonizasyon (ESI) yüksek çözünürlüklü kütle spektrometrisi (HRMS) kullanılarak gelişmiş tanımlama (ID) hassasiyeti. Niceliklendirme, gen ontolojisinden (GO) elde edilen bilgilerle bağlantılı olarak hipotez odaklı çalışmalar için yeni bilgiler sağlayan düzensizliği ortaya çıkardı. Şekillerreferans 15’ten izin alınarak uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu protokol, Xenopus türlerinin embriyolarında tanımlanmış hücre soylarında protein ekspresyonunun karakterizasyonunu sağlar. HRMS’den kaynaklanan metodoloji, moleküler tanımlamada mükemmel özgüllüğü, moleküler problar (genellikle yüzlerce ila binlerce farklı protein) olmadan çoklu protein tespiti yeteneğini ve niceleme yeteneğini birleştirir. Hücre ve gelişimsel (nöro) biyolojideki klasik araçlara ve iş akışlarına uyarlanabilirlik, HRMS proteomiklerini, omurgalı X. laevis </e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Jie Li’ye (Maryland Üniversitesi, College Park) embriyonik ayrışma ve FACS hakkındaki değerli tartışmalar için minnettarız. Vi M. Quach ve Camille Lombard-Banek’e, bu protokolde vurgulanan proteomik uygulamaları örnekleyen önceki çalışmalarda numune hazırlama ve veri toplama konusundaki yardımları için teşekkür ederiz. Bu çalışmanın bazı bölümleri IOS-1832968 KARİYER (P.N.’ye) ödül numarası altında Ulusal Bilim Vakfı, R35GM124755 ödül numarası altında Ulusal Sağlık Enstitüleri (P.N.’ye), Maryland Üniversitesi-Ulusal Kanser Enstitüsü Ortaklık Programı (P.N.’ye) ve COSMOS Club Vakfı araştırma ödülleri (A.B.B. ve L.R.P.’ye) tarafından desteklenmiştir.
Materials
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Agarose | ThermoFisher Scientific | R0492 | |
| Ammonium bicarbonate | Fisher Scientific | A643-500 | |
| Analytical Column | Thermo Scientific | 164941 | |
| Analytical microbalance | Mettler-Toledo | XSE105DU | |
| Automatic peptide fractionation platform | Agilent | 1260 Infinity II | |
| Borosilicate Capillaries | Sutter Instruments Co. | B100-50-10 | |
| Borosilicate Capillaries (for making Emmitters) | Sutter Instruments | B100-75-10 | |
| C18 spin columns (for desalting) | ThermoFisher Scientific | 89870 | |
| Camera ro monitor electrospray | Edmund Optics Inc. | EO-2018C | |
| Combretastatin A4 | Millipore Sigma | C7744 | |
| Commercial CESI system | AB SCIEX | CESI | |
| (Cyclohexylamino)-1-propanesulfonic acid (CAPS) | VWR | 97061-492 | |
| Cytochalasin D | Millipore Sigma | C8273 | |
| Dextran, Alexa Fluor 488; 10,000 MW, Anionic, Fixable | ThermoFisher Scientific | D22910 | |
| Diothiothreitol | Fisher Scientific | FERR0861 | |
| Dumont #5 Forceps | Fine Science Tools | 11252-30 | |
| EDTA | Fisher Scientific | AAJ62786AP | |
| Epifluorescence light source | Lumencore | AURA III | |
| Eppendorf LoBing microcentrifuge tubes: protein | Fisher Scientific | 13-698-793 | |
| Formic acid (LC-MS-grade) | Fisher Scientific | A117-50 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Thermo Scientific | TSX40086A | |
| Fused silica capillary | Molex | 1088150596 | |
| Heat Block | Benchmark | BSH300 | |
| High pressure liquid Chromatography System | ThermoFisher Scientific | Dionex Ultimate 3000 RSLC nanosystem | |
| High voltage power supply | Spellman | CZE1000R | |
| High-resolution Mass Spectrometer | ThermoFisher Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | |
| HPLC caps | Thermo Scientific | C4013-40A | |
| HPLC Vials | Thermo Scientific | C4013-11 | |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide | Fisher Scientific | AC122275000 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Microcapillary puller | Suttor Instruments | P-2000 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Micropippette puller | Sutter Instruments Co. | P-1000 | |
| MS data analysis software, commercial | ProteomeDiscoverer | ||
| MS data analysis software, opensource | MaxQuant | ||
| non-idet 40 substitute | Millipore Sigma | 11754599001 | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Pierce 10 µL bed Zip-tips (for desalting) | ThermoFisher Scientific | 87782 | |
| Pierce bicinchoninic acid protein assay kit | ThermoFisher Scientific | 23225 | |
| Pierce quantitative colorimetric peptide assay | ThermoFisher Scientific | 23275 | |
| Pierce Trypsin Protease (MS Grade) | Fisher Scientific | PI90058 | |
| Protein LoBind vials | Eppendorf | 0030108434 , 0030108442 |
|
| Refrigerated Centrifuge | Eppendorf | 5430R | |
| Refrigerated Incubator | Thermo Scientific | PR505755R/3721 | |
| sodium isethionate | Millipore Sigma | 220078 | |
| sodium pyrophosphate | Sigma Aldrich | 221368-100G | |
| Stainless steel BGE vial | Custom-Built | ||
| Stainless steel sample vials | Custom-Built | ||
| Stereomicroscope (objective 10x) | Nikon | SMZ 1270, SZX18 | |
| Sucrose | VWR | 97063-790 | |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Syringes (gas-tight): 500–1000 µL | Hamilton | 1750TTL | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Trap Column | Thermo Scientific | 164750 | |
| Tris-HCl (1 M solution) | Fisher Scientific | AAJ22638AP | |
| Vacuum concentrator capable of operation at 4–10 °C | Labconco | 7310022 | |
| Vortex-mixer | Benchmark | BS-VM-1000 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-Built |
References
- Shoemaker, L. D., Kornblum, H. I. Neural Stem Cells (NSCs) and Proteomics. Molecular & Cellular Proteomics. 15 (2), 344-354 (2016).
- Cervenka, J., et al. Proteomic characterization of human neural stem cells and their secretome during in vitro differentiation. Frontiers in Cellular Neuroscience. 14, 612560 (2021).
- Christian, J. L. Morphogen gradients in development: From form to function. Wiley Interdisciplinary Reviews. Developmental Biology. 1 (1), 3-15 (2012).
- Gurdon, J. B., Elsdale, T. R., M, F. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature. 182, 64-65 (1958).
- Harland, R. M., Grainger, R. M. Xenopus research: metamorphosed by genetics and genomics. Trends in Genetics. 27 (12), 507-515 (2011).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. 发育生物学. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell stage Xenopus embryo. 发育生物学. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Sun, L. L., et al. Single cell proteomics using frog (Xenopus laevis) blastomeres isolated from early stage embryos, which form a geometric progression in protein content. Analytical Chemistry. 88 (13), 6653-6657 (2016).
- Lombard-Banek, C., Moody, S. A., Nemes, P. Single-cell mass spectrometry for discovery proteomics: quantifying translational cell heterogeneity in the 16-cell frog (Xenopus) embryo. Angewandte Chemie-International Edition. 55 (7), 2454-2458 (2016).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
- Briggs, J. A., et al. The dynamics of gene expression in vertebrate embryogenesis at single-cell resolution. Science. 360 (6392), (2018).
- Gupta, M., Sonnett, M., Ryazanova, L., Presler, M., Wuhr, M., Vleminckx, K. Quantitative proteomics of xenopus embryos I, sample preparation. Xenopus. Methods in Molecular Biology. 1865, 175-194 (2018).
- Baxi, A. B., Lombard-Banek, C., Moody, S. A., Nemes, P. Proteomic characterization of the neural ectoderm fated cell clones in the Xenopus laevis embryo by high-resolution mass spectrometry. ACS Chemical Neuroscience. 9 (8), 2064-2073 (2018).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods in Molecular Biology. 135, 331-347 (2000).
- Sater, A. K., Moody, S. A. Using Xenopus to understand human diseases and developmental disorders. Genesis. 55 (1-2), 1-14 (2017).
- Lombard-Banek, C., Choi, S. B., Nemes, P., Allbritton, N. L., Kovarik, M. L. . Enzyme Activity in Single Cells. Methods in Enzymology. 628, 263-292 (2019).
- Lombard-Banek, C., Moody, S. A., Nemes, P. High-sensitivity mass spectrometry for probing gene translation in single embryonic cells in the early frog (Xenopus) embryo. Frontiers in Cell and Developmental Biology. 4, 11 (2016).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. Microprobe capillary electrophoresis mass spectrometry for single-cell metabolomics in live frog (Xenopus laevis) embryos. Journal of Visualized Experiments: JoVE. (130), e56956 (2017).
- Lombard-Banek, C., Moody, S. A., Manzin, M. C., Nemes, P. Microsampling capillary electrophoresis mass spectrometry enables single-cell proteomics in complex tissues: developing cell clones in live Xenopus laevis and zebrafish embryos. Analytical Chemistry. 91 (7), 4797-4805 (2019).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. 发育生物学. 120 (1), 299-304 (1987).
- Karimi, K., et al. Xenbase: a genomic, epigenomic and transcriptomic model organism database. Nucleic Acids Research. 46 (1), 861-868 (2018).
- Kakebeen, A. D., Chitsazan, A. D., Wills, A. E. Tissue disaggregation and isolation of specific cell types from transgenic Xenopus appendages for transcriptional analysis by FACS. Developmental Dynamics. 250 (9), 1381-1392 (2021).
- Garcia, B. A. What does the future hold for top down mass spectrometry. Journal of the American Society for Mass Spectrometry. 21 (2), 193-202 (2010).
- Toby, T. K., Fornelli, L., Kelleher, N. L. Progress in top-down proteomics and the analysis of proteoforms. Annual Review of Analytical Chemistry. (Palo Alto Calif). 9 (1), 499-519 (2016).
- Zhang, Z. B., Dubiak, K. M., Huber, P. W., Dovichi, N. J. Miniaturized filter-aided sample preparation (MICRO-FASP) method for high throughput, ultrasensitive proteomics sample preparation reveals proteome asymmetry in Xenopus laevis Embryos. Analytical Chemistry. 92 (7), 5554-5560 (2020).
- Wisniewski, J. R., Becher, D. . Microbial Proteomics: Methods and Protocols.Methods in Molecular Biology. 1841, 3-10 (2018).
- Hughes, C. S., et al. Single-pot, solid-phase-enhanced sample preparation for proteomics experiments. Nature Protocols. 14 (1), 68-85 (2019).
- Zhu, Y., et al. Nanodroplet processing platform for deep and quantitative proteome profiling of 10-100 mammalian cells. Nature Communications. 9, 882 (2018).
- Wessel, D., Flugge, U. I. A method for the quantitative recovery of protein in dilute-solution in the presence of detergents and lipids. Analytical Biochemistry. 138 (1), 141-143 (1984).
- Jiang, L., He, L., Fountoulakis, M. Comparison of protein precipitation methods for sample preparation prior to proteomic analysis. Journal of Chromatography A. 1023 (2), 317-320 (2004).
- Hildonen, S., Halvorsen, T. G., Reubsaet, L. Why less is more when generating tryptic peptides in bottom-up proteomics. Proteomics. 14 (17-18), 2031-2041 (2014).
- Budnik, B., Levy, E., Harmange, G., Slavov, N. SCoPE-MS: mass spectrometry of single mammalian cells quantifies proteome heterogeneity during cell differentiation. Genome Biology. 19, 161 (2018).
- Drouin, N., et al. Capillary electrophoresis-mass spectrometry at trial by metabo-ring: effective electrophoretic mobility for reproducible and robust compound annotation. Analytical Chemistry. 92 (20), 14103-14112 (2020).
- Sun, L. L., Zhu, G. J., Zhang, Z. B., Mou, S., Dovichi, N. J. Third-generation electrokinetically pumped sheath-flow nanospray interface with improved stability and sensitivity for automated capillary zone electrophoresis-mass spectrometry analysis of complex proteome digests. Journal of Proteome Research. 14 (5), 2312-2321 (2015).
- DeLaney, K., Sauer, C. S., Vu, N. Q., Li, L. J. Recent advances and new perspectives in capillary electrophoresis-mass spectrometry for single cell "omics". Molecules. 24 (1), 21 (2019).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nature Protocols. 8 (4), 783-799 (2013).
- Choi, S. B., Zamarbide, M., Manzini, M. C., Nemes, P. Tapered-tip capillary electrophoresis nano-electrospray ionization mass spectrometry for ultrasensitive proteomics: the mouse cortex. Journal of the American Society for Mass Spectrometry. 28 (4), 597-607 (2017).
- Pino, L. K., Rose, J., O’Broin, A., Shah, S., Schilling, B. Emerging mass spectrometry-based proteomics methodologies for novel biomedical applications. Biochemical Society Transactions. 48 (5), 1953-1966 (2020).
- Chen, C., Hou, J., Tanner, J. J., Cheng, J. L. Bioinformatics methods for mass spectrometry-based proteomics data analysis. International Journal of Molecular Sciences. 21 (8), 25 (2020).
- Peshkin, L., et al. On the relationship of protein and mRNA dynamics in vertebrate embryonic development. Developmental Cell. 35 (3), 383-394 (2015).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Gygi, S. P., et al. Quantitative analysis of complex protein mixtures using isotope-coded affinity tags. Nature Biotechnology. 17 (10), 994-999 (1999).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Analytical Chemistry. 75 (8), 1895-1904 (2003).
- Mi, H. Y., et al. PANTHER version 16: a revised family classification, tree-based classification tool, enhancer regions and extensive api. Nucleic Acids Research. 49, 394-403 (2021).
- Schmidt, E., et al. . On the Move Federated Workshops. , 710-719 (2006).
- Deutsch, E. W., et al. Trans-Proteomic pipeline, a standardized data processing pipeline for large-scale reproducible proteomics informatics. Proteomics Clinical Applications. 9 (7-8), 745-754 (2015).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Demsar, J., et al. Orange: Data mining toolbox in Python. Journal of Machine Learning Research. 14, 2349-2353 (2013).
- Oberg, A. L., Vitek, O. Statistical design of quantitative mass spectrometry-based proteomic experiments. Journal of Proteome Research. 8 (5), 2144-2156 (2009).
- Jensen, L. J., et al. STRING 8 – a global view on proteins and their functional interactions in 630 organisms. Nucleic Acids Research. 37, 412-416 (2009).
- Schweppe, D. K., Huttlin, E. L., Harper, J. W., Gygi, S. P. BioPlex display: an interactive suite for large-scale AP-MS protein-protein interaction data. Journal of Proteome Research. 17 (1), 722-726 (2018).
- Hornbeck, P. V., et al. PhosphoSitePlus, 2014: mutations, PTMs and recalibrations. Nucleic Acids Research. 43, 512-520 (2015).
- Letunic, I., Khedkar, S., Bork, P. SMART: recent updates, new developments and status in 2020. Nucleic Acids Research. 49, 458-460 (2021).
- Lombard-Banek, C., et al. In vivo subcellular mass spectrometry enables proteo-metabolomic single-cell systems biology in a chordate embryo developing to a normally behaving tadpole (X. laevis). Angewandte Chemie-International Edition. 60 (23), 12852-12858 (2021).
- Lombard-Banek, C., Reddy, S., Moody, S. A., Nemes, P. Label-free quantification of proteins in single embryonic cells with neural fate in the cleavage-stage frog (Xenopus laevis) embryo using capillary electrophoresis electrospray ionization high-resolution mass spectrometry (CE-ESI-HRMS). Molecular & Cellular Proteomics. 15 (8), 2756-2768 (2016).
- Saha-Shah, A., et al. Single cell proteomics by data-independent acquisition to study embryonic asymmetry in Xenopus laevis. Analytical Chemistry. 91 (14), 8891-8899 (2019).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Analytical Chemistry. 89 (13), 7069-7076 (2017).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).

