A Simple Kritische-sized Femorale Defect Model in Muizen
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Geschat wordt dat de helft van de Amerikaanse bevolking ervaart een fractuur door de leeftijd van 65 1. Voor die patiënten met fracturen behandeld chirurgisch, 500.000 procedures gepaard met het gebruik van een bottransplantatie 2 en dit aantal zal naar verwachting stijgen met de toenemende vergrijzing 3 . Hoewel bot is een van de weinige organen die het vermogen volledig genezen zonder littekens heeft, zijn er gevallen waarin het mislukt 3,4. Afhankelijk van de omstandigheden en de kwaliteit van de behandeling, 2-30% van de lange botbreuken mislukken, wat resulteert in niet-union 3,5. Hoewel er enige discussie over de definitie, pseudoartrose, kritisch-sized of non-union verwondingen bot blijft over het algemeen verwijst naar een blessure die niet geneest over de natuurlijke levensduur van het onderwerp 6. Voor experimentele doeleinden wordt de looptijd verkort tot de gemiddelde tijd vereist voor volledige genezing van een middelgroot botletsel. Non-union botlaesies optreden voor numerous redenen, maar de belangrijkste factoren zijn onder extreme trauma resulteert in een kritisch-sized gat, infectie, slechte angiogenese, het gebruik van tabak, of geremd osteoregenerative capaciteit als gevolg van ziekte of leeftijd 7. Hoewel non-unions succesvol behandeld kan kosten dan $ 60.000 per procedure, afhankelijk van het type van verwonding en de benaderingen toegepast 8.
In matige gevallen wordt autologe bottransplantatie tewerkgesteld. Deze strategie omvat herstel van bot van een donor plaats en implantatie op de plaats van verwonding. Deze aanpak is bijzonder effectief, de hoeveelheid beschikbare donor afgeleide bot is beperkt en de procedure omvat een nieuwe ingreep, waardoor aanhoudende pijn bij veel patiënten 9,10. Bovendien is de effectiviteit van de autoloog bottransplantaat is afhankelijk van de gezondheid van de patiënt. Botsubstituten gemaakt van synthetische materialen of verwerkt cadaveric bot zijn overvloedig beschikbaar 11-13, maar ze have belangrijke beperkingen, met inbegrip van slechte gastheer-cel adhesie eigenschappen, verminderd osteoconductiviteit, en de kans op afstoting 14. Er is dan ook dringend behoefte aan regeneratie van bot technologieën die veilig, effectief en op grote schaal beschikbaar zijn.
Ons vermogen om bot regeneratieve strategieën verbeteren kritisch afhankelijk van het vermogen om serieuze bot trauma nabootsen proefdieren, maar de vorming en stabilisatie van grote botletsels is technisch uitdagend. In de meeste gevallen wordt ernstig lange bot trauma experimenteel nagebootst door de oprichting van een defect dat van nature niet zal genezen. Hoewel het kan variëren met soorten 15, dit wordt bereikt door volledige verwijdering van een bot segment die groter is dan 1,5 maal de diameter van het bot doorsnede 16. Het bot wordt vervolgens gestabiliseerd met een metalen implantaat juiste oriëntatie van de breuk randen bewaren en de mobiliteit. Door hun kleine formaat en de kwetsbaarheid vanhun lange botten, oprichting van dergelijke letsels bij muizen zijn dan de mogelijkheden van de meeste onderzoeksgroepen. Als zodanig zijn lange botdefecten modellen beperkt tot ratten en grotere dieren. Toch muizen veroorloven belangrijk onderzoek voordelen in dat ze genetisch kunnen worden gemodificeerd en gefokt als immuun-gecompromitteerde stammen die geen menselijke cellen en weefsels niet in geloven.
Voor menselijke cel-gebaseerde applicaties, immuun-gecompromitteerde muizen zijn aantrekkelijk om mee te werken, omdat ze fysiologisch goed gekarakteriseerd, gemakkelijk te huis, kosteneffectief en eenvoudig geanalyseerd radiologisch en histologisch. Van groot belang is dat immuun-gecompromitteerde muizen geen cellen van verschillende soorten, waaronder de mens wijzen. Hun kleine formaat maakt ook het testen van zeer kleine aantallen cellen of volumes van experimentele steigers in orthopedische toepassingen. Verscheidene muizen orthopedische modellen gemeld dat verschillende mate been stabiliteit 17,18 veroorloven. Die systems die resulteren in zeer hoge stabiliteit, zoals externe fixators en sluitplaten voornamelijk genezend intramembraneuze ossificatie hoewel endochondrale genezing is gemeld 19. Daarentegen, die een aantal micro- en / of macro-beweging, zoals gebruik losgemaakt of gedeeltelijk vaste medullaire kunnen toestaan algemeen genezen met een overwicht van endochondrale ossificatie 20,21. Vertraagd unie of non-union defecten van lange botten zijn bijzonder moeilijk te bereiken bij muizen te wijten aan de extra niveau van stabilisatie nodig. Echter, een aantal benaderingen waargenomen, inclusief medullaire kunnen met elkaar verbindende spijkers, sluitplaten en externe fixators 22. Deze systemen over het algemeen goed te werken, maar gezien hun ingewikkelde ontwerp kunnen ze technisch uitdagend te installeren zijn. Bijvoorbeeld, Garcia et al. 23 bedacht elegante interlocking pin voor gebruik in muizen, maar de procedure omvat incisies op twee aparte sites en uitgebreide modificatie van de femur de pennen passen. Deze procedures werden uitgevoerd onder een dissectie microscoop.
Hierin beschrijven we een eenvoudige femorale medullaire pen met een centrale kraag ontworpen om sluiting van een 3 mm tekort bot voorkomen en ook toespitsen op het oorspronkelijke randen van het defect. Terwijl de pen is niet bevestigd aan het bot zelf, nauwkeurige dimensionering van de pendiameter en ruimen van de mergholte resultaten voldoende interferentie torsie- beweging (figuur 1) te verminderen. Met een zorgvuldige selectie van ingeteelde leeftijd, geslacht en stam afgestemd muizen, het resultaat is een zeer reproduceerbare hypertrofische niet- uniondefect 22 die gemakkelijk radiologisch kunnen worden geëvalueerd. Bovendien gebieden die van belang kan reproduceerbaar worden bepaald na micro-computertomografie (μCT) voor het meten van de novo botvorming en histomorfologische parameters. De pennen werden prototyped in ons laboratorium met behulp van gemakkelijk beschikbare hulpmiddelen.
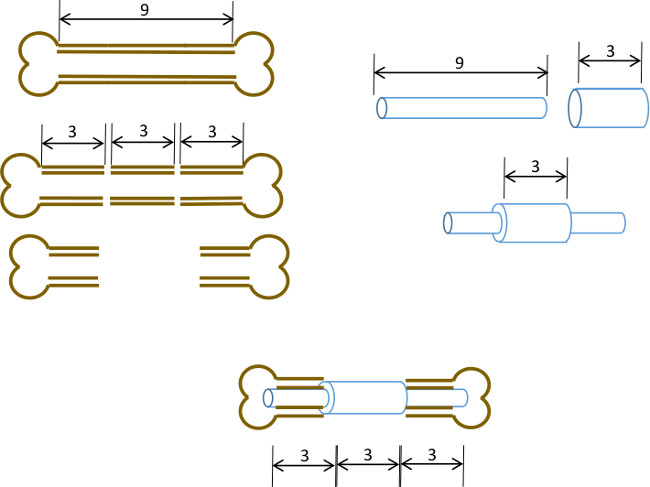
Figuur 1: Experimentele principe Schematische samenvatting van het segmentaal defect model.. De centrale 3 mm segment van 9-10 mm muis femur chirurgisch uitgesneden (links). Een 3 mm lang, 19 gauge chirurgisch stalen buis wordt over een 9 mm lang, 22 G roestvrijstalen buis Gelijmde precies in het midden (rechts). De resulterende pen wordt aangebracht in de medullaire kanalen van de resterende proximale en distale delen van het femur met 19 G kraag vervangen van 3 mm segment been (hierna, midden).
Protocol
Representative Results
Discussion
Hierin is een eenvoudige methode beschrijven we een kritisch-sized-pins gestabiliseerd defect van het muizen femur met standaard laboratorium en veterinaire apparatuur genereren. Terwijl de assemblage van de pennen en de chirurgische procedure zelf vereist oefening, het is ruim binnen de mogelijkheden van een goed opgeleide biomedisch onderzoek wetenschapper of dierenarts.
De pen wordt geplaatst in het medullaire kanaal zonder extra fixatie, waardoor de procedure technisch haalbaar dan ingew…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wij danken het personeel en dierenartsen bij de Scott & White Ziekenhuis Vakgroep Vergelijkende Geneeskunde, Temple, Texas, voor hun waardevolle advies en hulp bij de ontwikkeling van deze techniek. Dit werk werd deels gefinancierd door het Institute for Regenerative Medicine Program Funds, Scott & White RGP subsidie # 90.172, NIH 2P40RR017447-07 en NIH R01AR066033-01 (NIAMS). Wij danken Dr Suzanne Zeitouni voor proofing het manuscript.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

