Un semplice Critical dimensioni femorale Difetto Modello in Mice
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Si stima che la metà della popolazione degli Stati Uniti sperimentare una frattura all'età di 65 1. Per i pazienti con fratture trattate chirurgicamente, 500.000 procedure comportano l'uso di un innesto osseo 2 e questo numero è destinato ad aumentare con una popolazione sempre più anziana 3 . Sebbene osso è uno dei pochi organi che ha la capacità di guarire completamente senza cicatrici, ci sono casi in cui il processo non riesce 3,4. A seconda delle circostanze e la qualità del trattamento, 2-30% delle fratture delle ossa lunghe fallire, con conseguente non-union 3,5. Mentre rimane qualche dibattito sulla definizione, pseudoartrosi, lesioni ossee critici-size o non sindacalizzati in genere si riferisce a un infortunio che non guarisce tutta la durata naturale del soggetto 6. Ai fini sperimentali, tale durata è ridotta al tempo medio necessario per la completa guarigione di una ferita di medie dimensioni delle ossa. Lesioni ossee non sindacali si verificano per nummotivi erous, ma i principali fattori includono traumi estremi conseguente gap critico dimensioni, infezione, povero angiogenesi, uso di tabacco, o la capacità osteoregenerative inibito a causa di malattie o 7 anni. Anche se non unioni sono trattati con successo, può costare oltre $ 60.000 al procedimento, a seconda del tipo di lesione e gli approcci impiegati 8.
In casi moderati, innesto osseo autologo è impiegato. Questa strategia comporta il recupero di osso da un sito donatore e l'impianto nel sito di lesione. Mentre questo approccio è estremamente efficace, il volume di osso disponibile donatore-derivato è limitata e la procedura prevede un ulteriore intervento chirurgico, che si traduce in dolore persistente in molti pazienti 9,10. Inoltre, l'efficacia dell'innesto osseo autologo dipende della salute del paziente. Sostituti ossei in materiali sintetici o di osso da cadavere elaborati sono disponibili in abbondanza 11-13, ma HAve significative limitazioni, tra cui scarse proprietà di adesione della cellula ospite, ridotto osteoconduttività, e la possibilità di rigetto immunitario 14. Vi è quindi un urgente bisogno di tecnologie di rigenerazione ossea che sono sicuri, efficaci e ampiamente disponibile.
La nostra capacità di migliorare le strategie di rigenerazione dell'osso è criticamente dipendente dalla capacità di imitare gravi traumi ossei in animali da laboratorio, ma la generazione e la stabilizzazione di grandi lesioni ossee è tecnicamente impegnativo. Nella maggior parte dei casi, gravi traumi delle ossa lunghe è imitato sperimentalmente stabilendo un difetto che non guarire naturalmente. Anche se può variare con specie 15, questo si ottiene la rimozione completa di un segmento osseo che è maggiore di 1,5 volte il diametro dell'osso sezione 16. L'osso viene poi stabilizzato con un impianto metallico per mantenere il corretto orientamento dei bordi di frattura e consentire la mobilità. A causa della loro piccola dimensione e la fragilitàle ossa lunghe, la creazione di tali lesioni nei topi sono oltre le capacità della maggior parte dei gruppi di ricerca. Come tale, i modelli difettosi delle ossa lunghe sono limitati a ratti e animali più grandi. Tuttavia, i topi offrono notevoli vantaggi di ricerca in quanto possono essere geneticamente modificati e allevati come ceppi immunocompromessi che non rifiutano le cellule e tessuti umani.
Per le applicazioni basate sulle cellule umane, i topi immunocompromessi sono attraenti per lavorare con perché sono fisiologicamente ben caratterizzati, facile da casa, redditizio, e facilmente analizzati radiologicamente e istologicamente. Di fondamentale importanza è che i topi immunocompromessi non rifiutano le cellule di specie diverse, tra cui l'uomo. Le loro piccole dimensioni permette anche la sperimentazione di un numero esiguo di cellule o volumi di ponteggi sperimentali in applicazioni ortopediche. Diversi modelli murini ortopedici sono stati segnalati che offrono vari gradi di stabilità ossea 17,18. Quelli systems che si traducono in livelli molto elevati di stabilità, come fissatori esterni e piastre di bloccaggio prevalentemente guarire da ossificazione intramembranosa anche se la guarigione endochondral è stato segnalato 19. Al contrario, quelli che permettono alcune micro e / o macro-motion, come quelle che impiegano i perni midollari non fissati o parzialmente fissi, in genere guariscono con una predominanza di encondrale 20,21. Unione ritardata o difetti non sindacali di ossa lunghe sono particolarmente difficili da realizzare nei topi a causa del livello extra di stabilizzazione necessaria. Tuttavia, una serie di approcci sono stati segnalati, tra cui i perni midollari con chiodi ad incastro, piastre di bloccaggio e fissatori esterni 22. Questi sistemi generalmente funzionano bene, ma data la loro progettazione complicata possono essere tecnicamente difficile da installare. Ad esempio, Garcia et al. 23 escogitato un elegante sistema pin incastro per l'uso nei topi, ma la procedura prevede due incisioni a sito separatos ed una sostanziale modifica del femore per accogliere i perni. Queste procedure sono state eseguite sotto un microscopio da dissezione.
Qui, descriviamo un semplice perno midollare femorale con un collare centrale progettata per impedire la chiusura di un deficit ossea 3 mm e anche delineare i bordi originali del difetto. Mentre il perno non è stato fissato all'osso stesso, accurato dimensionamento del diametro del perno e alesatura dei risultati cavità midollare in interferenza sufficiente a minimizzare il movimento torsionale (Figura 1). Con un'attenta selezione di età inbred, genere e topi ceppo corrispondenza, il risultato è un altamente riproducibile ipertrofica non uniondefect 22 che può essere facilmente valutata radiologicamente. Inoltre le regioni di interesse possono essere definite in modo riproducibile dopo micro-tomografia computerizzata (μCT) per la misura di de novo formazione ossea e parametri istomorfologici. I perni sono stati prototipati nel nostro laboratorio utilizzando strumenti facilmente reperibili.
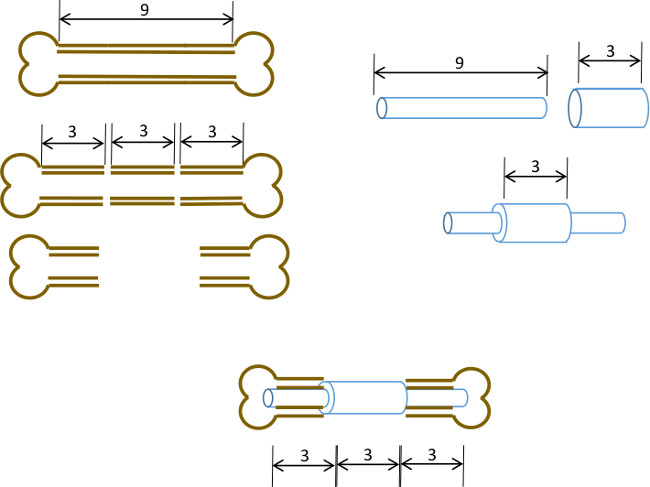
Figura 1: principio sperimentale sintesi schematica del modello di difetto segmentale.. Il segmento centrale 3 mm un femore murino 9-10 mm viene asportato chirurgicamente (a sinistra). A, 19 calibro tubo di acciaio chirurgico, lunga 3 mm, è passata sopra a 9 mm di lunghezza, 22 G tubo di acciaio inox e fissato con adesivo al centro esatto (a destra). Il perno risultante è montato nei canali midollari dei restanti porzioni prossimali e distali del femore con il collare 19 G sostituzione del segmento 3 mm dell'osso (di seguito, al centro).
Protocol
Representative Results
Discussion
Qui, si descrive un metodo semplice per generare un difetto critico-sized pin-stabilizzato del femore murino utilizzando standard di laboratorio e veterinari. Mentre l'assemblea dei perni e la procedura chirurgica in sé richiede pratica, è bene alla portata di un ricercatore biomedico ben addestrato o veterinario.
Il perno è posizionato nel canale midollare senza fissazione aggiuntiva, rendendo il procedimento tecnicamente più fattibile rispetto agli approcci più complicati che impi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ringraziamo il personale e veterinari presso il Dipartimento di Medicina comparativa, Tempio, Texas Scott & White Hospital, per i loro consigli e la preziosa collaborazione durante lo sviluppo di questa tecnica. Questo lavoro è stato finanziato in parte da L'Istituto per la medicina rigenerativa Programma Fondi, Scott & White RGP concessione # 90172, NIH 2P40RR017447-07 e NIH R01AR066033-01 (NIAMS). Ringraziamo il dottor Suzanne Zeitouni per proofing il manoscritto.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

