Eine einfache Kritische große Femoral Defect Modell an der Maus
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Es wird geschätzt, dass die Hälfte der US-Bevölkerung erleben eine Fraktur von 65 Jahren ein. Für die Patienten mit Frakturen behandelt, chirurgisch, 500.000 Verfahren beinhalten die Verwendung eines Knochentransplantat 2, und diese Zahl wird voraussichtlich mit einer immer älter werdenden Bevölkerung 3 steigen . Obwohl Knochen ist eines der wenigen Organen, die die Fähigkeit, vollständig zu heilen, ohne Narbenbildung hat, gibt es Fälle, wo der Prozess aus 3,4. Abhängig von den Gegebenheiten und die Qualität der Behandlung, 2-30% der Frakturen langer Röhrenknochen ausfallen und dadurch den nicht gewerkschaftlich 3,5. Zwar gibt es noch einige Diskussionen über die Definition, Pseudoarthrose, kritische große oder nicht gewerkschaftlich Knochenverletzungen in der Regel bezieht sich auf eine Verletzung, die nicht über die natürliche Lebensdauer des Gegenstandes 6 heilt. Zu Versuchszwecken wird diese Dauer auf die durchschnittliche Zeit bis zur vollständigen Heilung einer mittelgroßen Knochenverletzung erforderlich ist, verkürzt. Nicht gewerkschaftlich Knochenläsionen treten für numerous Gründen, aber wichtigen Faktoren gehören extreme Trauma in einem kritisch große Lücke, Infektionen, schlechte Angiogenese, Tabakkonsum, oder gehemmt osteoregenerative Leistung durch Krankheit oder Alter von 7 Jahren. Selbst wenn Pseudarthrosenbildung erfolgreich behandelt wird, kann es über 60.000 US-Dollar pro Vorgang kostet, abhängig von der Art der Verletzung und den verwendeten 8 Ansätze.
In mittelschweren Fällen wird autologen Knochentransplantation beschäftigt. Diese Strategie beinhaltet die Gewinnung von Knochen aus einem Donor-Stelle und der Implantation an der Stelle der Verletzung. Dieser Ansatz ist zwar sehr wirksam ist, ist das Volumen der verfügbaren Spender abgeleiteten Knochens begrenzt und das Verfahren führt eine zusätzliche Operation, die in chronischen Schmerzen bei vielen Patienten 9,10 ergibt. Darüber hinaus ist die Wirksamkeit des autologen Knochentransplantat abhängig von der Gesundheit des Patienten. Knochenersatz aus synthetischen Materialien oder verarbeitet Leichenknochen sind reichlich vorhanden 11-13, aber sie have erheblichen Einschränkungen, einschließlich schlechte Wirtszellhaftungseigenschaften, reduziert Osteokonduktivität, und das Potenzial für Immunabwehr 14. Es besteht daher ein dringender Bedarf für die Knochenregeneration Technologien, sicher, effektiv und weit verbreitet sind.
Unsere Fähigkeit, Knochenregenerationsstrategien verbessern hängt entscheidend von der Fähigkeit, schweren Knochentrauma bei Versuchstieren zu imitieren, aber die Erzeugung und Stabilisierung von großen Knochenläsionen ist technisch anspruchsvoll. In den meisten Fällen wird ernsthafte langKnochenTrauma experimentell durch die Schaffung eines Mangels, die nicht natürlich heilen wird nachgeahmt. Kann aber auch mit 15 Arten variieren, wird dies durch die vollständige Entfernung eines Knochensegments, die größer als das 1,5-fache des Durchmessers des Knochenquerschnitts 16 ist erreicht. Der Knochen wird dann mit einem Metallimplantat stabilisiert, um eine ordnungsgemäße Orientierung der Bruchkanten erhalten bleibt und die Mobilität. Aufgrund ihrer geringen Größe und der Zerbrechlichkeitihre langen Knochen, Einrichtung solcher Läsionen bei Mäusen sind über die Fähigkeiten der meisten Forschungsgruppen. Als solche sind lange Knochendefekt Modellen an Ratten und größere Tiere beschränkt. Dennoch Mäusen leisten bedeutende Forschung Vorteile, dass sie genetisch modifiziert und als immungeschwächten Stämme, die nicht die menschliche Zellen und Gewebe zurückweisen gezüchtet werden.
Für menschliche Zell-basierte Anwendungen sind immungeschwächten Mäusen attraktiv, mit, weil sie physiologisch gut charakterisiert, einfach zu Hause zu arbeiten, kostengünstig, und analysiert radiologisch und histologisch leicht. Von größter Bedeutung ist, dass immungeschwächten Mäusen keine Zellen verschiedener Arten einschließlich des Menschen ablehnen. Ihre geringe Größe erlaubt auch die Prüfung von sehr kleinen Anzahl von Zellen oder Volumina Versuchsgerüste in orthopädischen Anwendungen. Mehrere Maus orthopädischen Modellen berichtet worden, dass verschiedene Grade der Knochenstabilität 17,18 leisten. Diejenigen systems, die eine sehr hohe Stabilität, wie externe Fixatoren und Schließbleche führen überwiegend durch intramembranöse Verknöcherung zu heilen, obwohl endochondralen Heilung wurde berichtet, 19. Im Gegensatz dazu diejenigen, die einige der Mikro- und / oder Makro-Bewegung, wie beispielsweise jene, die nicht fixierten oder teilweise fixierten Markstiften zu ermöglichen, in der Regel zu heilen mit einer Dominanz von endochondralen Verknöcherung 20,21. Verzögerte Gewerkschaft oder nicht gewerkschaftlich Mängel Röhrenknochen sind besonders schwer zu erreichen bei Mäusen durch die zusätzliche Ebene der Stabilisierung erforderlich. Allerdings sind eine Reihe von Ansätzen wurde berichtet, einschließlich Markstiften mit Verriegelungsnägeln, Verriegelungsplatten und externe Fixatoren 22. Diese Systeme in der Regel gut, aber aufgrund ihrer komplizierten Konstruktion technisch anspruchsvoll sie zu installieren sein. Beispielsweise Garcia et al. 23 entwickelt eine elegante Verriegelungsstift System zur Verwendung bei Mäusen, aber das Verfahren führt Einschnitte an zwei getrennten Standorts und umfangreiche Modifikation des Femurs, um die Stifte aufzunehmen. Diese Verfahren wurden unter einem Präpariermikroskop geführt.
Hier beschreiben wir eine einfache Schenkelmarknagel mit einem zentralen Kragen zur Schließung einer 3 mm Knochendefizit zu verhindern und auch beschreiben die ursprünglichen Ränder des Defekts. Während der Stift nicht an den Knochen selbst befestigt, und zwar Dimensionierung der Stiftdurchmesser und Aufreiben der Markhöhle zu einer ausreichenden Interferenz Torsionsbewegung (Figur 1) zu minimieren. Mit einer sorgfältigen Auswahl der Inzucht-Alter, Geschlecht und Stamm-Mäusen abgestimmt, ist das Ergebnis eine hohe Reproduzierbarkeit der hypertrophen nicht uniondefect 22, die leicht radiologisch ausgewertet werden können. Außerdem interessierende Bereiche reproduzierbar nach Mikrocomputertomographie (μCT) zur Messung der de novo Knochenbildung und histomorphologischen Parameter definiert werden. Die Stifte wurden in unserem Labor mit leicht verfügbaren Werkzeuge Prototyp.
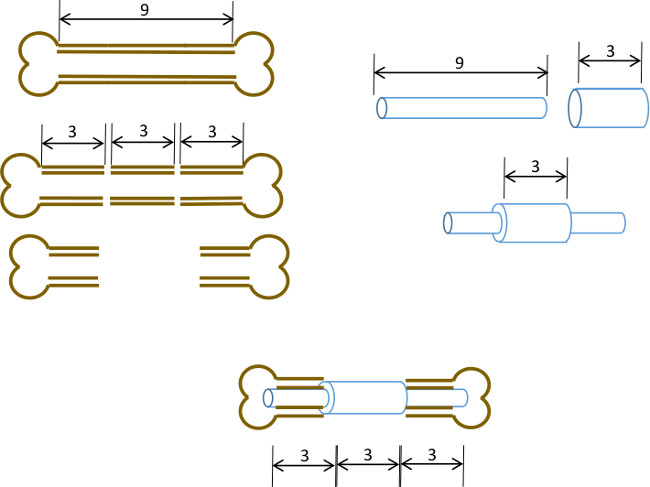
Abbildung 1: Versuchsprinzip Schematische Zusammenfassung der segmentalen Defekt-Modell.. Das zentrale 3 mm Segment einer 9-10 mm Maus Femur chirurgisch entfernt (links). Ein 3 mm lang, 19 Gauge chirurgischen Stahlrohr wird über eine 9 mm lange, 22 G Edelstahlrohr genau in der Mitte (rechts) geleitet und mit Klebstoff fixiert. Die sich ergebende Stift in die Markkanäle der verbleibenden proximalen und distalen Abschnitt des Oberschenkelknochens mit der 19G Kragen die 3 mm Knochensegment ersetzen (unten Mitte) ausgestattet.
Protocol
Representative Results
Discussion
Hier beschreiben wir eine einfache Methode, um eine kritische großen Stift stabilisierten Defekt der Maus Femur mit Standard-Labor- und Tierarztausrüstung zu generieren. Während der Montage der Stifte und der Operation selbst benötigt der Praxis ist es im Rahmen der Fähigkeiten eines gut ausgebildeten biomedizinischen Forschung Wissenschaftler oder Tierarzt.
Der Stift wird in den Markraum ohne zusätzliche Fixierung positioniert, wodurch das Verfahren technisch machbar als komplizierter…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken dem Personal und Tierärzte an der Scott & White Krankenhaus Abteilung für Vergleichende Medizin, Temple, Texas, für ihre wertvolle Beratung und Unterstützung bei der Entwicklung dieser Technik. Diese Arbeit wurde teilweise durch das Institut für Regenerative Medizin Programm Funds, Scott & White RGP Zuschuss # 90.172, NIH 2P40RR017447-07 und NIH R01AR066033-01 (NIAMS) gefördert. Wir danken Dr. Suzanne Zeitouni für das Proofing das Manuskript.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

