Um Defeito modelo simples Critical porte Femoral em Ratos
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Estima-se que metade da população dos EUA experimentar uma fratura por 65 anos de idade 1. Para aqueles pacientes com fraturas tratadas cirurgicamente, 500.000 procedimentos envolvem o uso de um enxerto ósseo 2 e este número deverá aumentar com uma população cada vez mais envelhecida 3 . Embora o osso é um dos poucos órgãos que tem a capacidade de curar completamente sem formação de cicatrizes, existem casos em que o processo falha 3,4. Dependendo das circunstâncias e qualidade do tratamento, 2-30% das fraturas de ossos longos falhar, resultando na não-união 3,5. Embora ainda haja alguma debate para a definição, pseudo-artrose, lesões ósseas críticas porte ou não sindicalizados geralmente se refere a uma lesão que não cicatriza sobre a vida natural do sujeito 6. Para fins experimentais, a sua duração for encurtado para o tempo médio necessário para a cura completa de uma lesão óssea de tamanho médio. Lesões ósseas não-sindicalizados ocorrer numerous razões, mas os principais fatores incluem trauma extremo resultando em uma lacuna crítica porte, infecção, má angiogênese, o uso do tabaco, ou a capacidade osteoregenerative inibido devido a doença ou 7 anos de idade. Mesmo se não uniões são tratados com sucesso, pode custar mais de US $ 60.000 por procedimento, dependendo do tipo de lesão e as abordagens empregadas 8.
Nos casos moderados, enxerto ósseo autólogo é empregado. Esta estratégia envolve a recuperação do osso a partir de um local dador e o implante no local da lesão. Enquanto esta abordagem é extremamente eficaz, o volume disponível de osso derivadas de dador é limitada e o procedimento envolve uma cirurgia adicional, que resulta em dor persistente em muitos pacientes 9,10. Além disso, a eficácia do enxerto ósseo autólogo é dependente da saúde do paciente. Substitutos ósseos feitos de materiais sintéticos ou de osso de doador falecido processados estão disponíveis em abundância 11-13, mas eles have limitações significativas, incluindo propriedades fraca adesão da célula hospedeira, reduzida osteocondutividade, e do potencial de rejeição imunológica 14. Há, portanto, uma necessidade urgente de tecnologias de regeneração óssea que são seguros, eficazes e amplamente disponível.
A nossa capacidade de melhorar as estratégias de regeneração óssea é extremamente dependente da capacidade de imitar trauma ósseo grave em animais de laboratório, mas a geração e estabilização das lesões ósseas grandes é tecnicamente desafiador. Na maioria dos casos, o trauma grave ossos longos é mimetizado experimentalmente através da criação de um defeito que não irá naturalmente curar. Embora possa variar com as espécies de 15, isto é conseguido por remoção completa de um segmento de osso que é maior do que 1,5 vezes o diâmetro da secção transversal do osso 16. O osso é então estabilizada com um implante de metal para manter a orientação adequada das arestas de fractura e para permitir a mobilidade. Devido ao seu pequeno tamanho e da fragilidade doseus ossos longos, o estabelecimento de tais lesões em camundongos estão além das capacidades da maioria dos grupos de pesquisa. Como tal, os modelos de defeitos dos ossos longos são confinadas a ratos e animais maiores. No entanto, os ratinhos proporcionam vantagens significativas de investigação em que eles podem ser modificados geneticamente e criadas estirpes como o sistema imunitário comprometido que não rejeitam as células e tecidos humanos.
Para aplicações baseadas em células humanas, os ratos imunocomprometidos são atraentes para trabalhar com eles, porque são fisiologicamente bem caracterizado, fácil de casa, de baixo custo e facilmente analisados radiologicamente e histologicamente. De suma importância é que os ratos imunocomprometidos não rejeitam as células de diferentes espécies, incluindo os seres humanos. O seu pequeno tamanho também permite o teste de um pequeno número de células ou volumes de andaimes experimentais em aplicações ortopédicas. Vários modelos murinos ortopédicos têm sido relatado que proporcionam vários graus de estabilidade óssea 17,18. Aqueles systems que resultam em níveis muito elevados de estabilidade, como fixadores externos e placas de bloqueio predominantemente curar por ossificação intramembranosa embora a cura endochondral tem sido relatada 19. Em contraste, aqueles que permitem alguma micro e / ou macro-motion, como as que utilizam pinos medulares não corrigidos ou parcialmente fixos, geralmente curar com uma predominância de ossificação 20,21. Retarde ou defeitos não sindicalizados de ossos longos são particularmente difíceis de alcançar em camundongos devido ao nível extra de estabilização necessária. No entanto, há relatos de um número de abordagens, incluindo pinos medulares com hastes bloqueadas, placas de bloqueio e fixadores externos 22. Esses sistemas geralmente funcionam bem, mas dado o seu projeto complicado que pode ser tecnicamente desafiadora para instalar. Por exemplo, Garcia et al. 23, concebeu um sistema de pino de bloqueio elegante para utilização em ratinhos, mas o procedimento envolve incisões em dois locais separadoss e extensa modificação do fémur para acomodar os pinos. Estes procedimentos foram realizados sob um microscópio de dissecação.
Descrevemos uma cavilha medular femoral simples, com uma gola central, concebido para impedir o fechamento de um défice de osso, 3 mm e também delinear as extremidades originais do defeito. Enquanto o pino não foi fixado ao próprio osso, dimensionamento preciso do diâmetro de pino e a fresagem dos resultados de cavidades medulares em interferência suficiente para minimizar o movimento de torção (Figura 1). Com cuidadosa seleção de idade inato, gênero e camundongos correspondida-deformação, o resultado é uma alta reprodutibilidade hipertrófica não-uniondefect 22, que pode ser facilmente avaliada radiologicamente. Além disso regiões de interesse podem ser reprodutível definido após computadorizada de micro tomografia (μCT) para a medição de de formação de osso novo e parâmetros histomorfológicos. Os pinos foram protótipo em nosso laboratório usando ferramentas facilmente disponíveis.
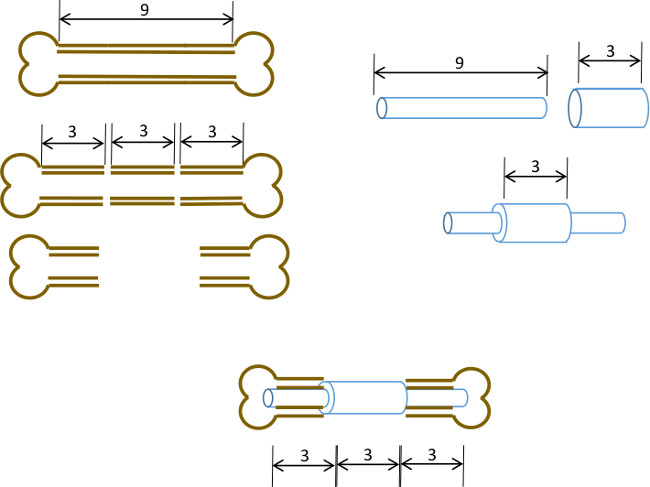
Figura 1: princípio Experimental resumo esquemática do modelo de defeito segmentar.. O centro de segmento de 3 mm 9-10 mm de um fémur murino é excisado cirurgicamente (esquerda). Um, de calibre 19 de tubo de aço cirúrgico 3 milímetros de comprimento é passado sobre um 9, 22 mm de comprimento L do tubo de aço inoxidável e fixado com adesivo no centro exacto (à direita). O pino resultante é encaixada os canais medulares das restantes porções proximais e distais do fémur com a gola 19 G substituindo o segmento de 3 mm de osso (em baixo, ao centro).
Protocol
Representative Results
Discussion
Relata-se um método simples para gerar um defeito crítico porte estabilizado pinos do fêmur murino usando padrão de laboratório e equipamentos veterinários. Enquanto a montagem dos pinos e do próprio procedimento cirúrgico requer prática, é bem dentro das capacidades de um cientista de pesquisa biomédica bem treinado ou veterinário.
O pino é posicionado no canal medular, sem fixação adicional, tornando o procedimento tecnicamente mais viável do que as abordagens mais complica…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a equipe e veterinários no Scott & White Hospital Department of Comparative Medicine, Temple, Texas, para os seus conselhos e ajuda inestimável durante o desenvolvimento desta técnica. Este trabalho foi financiado em parte pelo Instituto para a medicina regenerativa fundos do programa, Scott & White RGP concessão # 90172, NIH 2P40RR017447-07 e NIH R01AR066033-01 (NIAMS). Agradecemos ao Dr. Suzanne Zeitouni para provas do manuscrito.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

