דגם פגם עצם הירך קריטית בגודל פשוט בעכברים
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
הערכה היא כי מחצית מאוכלוסיית ארה"ב חווה שבר בגיל 65 1. עבור אותם מטופלים עם שברים שטופלו בניתוח, 500,000 הליכים כרוכים בשימוש בשתל עצם 2 ומספר זה צפוי לעלות עם הזדקנות אוכלוסייה יותר ויותר 3 . למרות שעצם הוא אחד מכמה איברים שיש את היכולת לרפא לחלוטין ללא צלקות, יש מקרים שבם התהליך נכשל 3,4. בהתאם לנסיבות ולאיכות טיפול, 2-30% משברים בעצמות ארוכות ייכשלו, וכתוצאה מכך 3,5 שאינו איגוד. אמנם יש עדיין ויכוח על ההגדרה, pseudoarthrosis, פציעות עצם הקריטיות בגודל או אי-איחוד בדרך כלל מתייחס לפגיעה שאינה נרפא במשך החיים הטבעיים של הנושא 6. למטרות ניסוי, משך זה מתקצר לזמן הממוצע שנדרש להחלמה של פציעה עצם בגודל ממוצעת מלאה. נגעי עצם ללא איחוד להתרחש numסיבות erous, אך גורמים עיקריים כוללות טראומה קיצונית וכתוצאה מכך פער קריטי בגודל, זיהום, אנגיוגנזה עניה, שימוש בטבק, או יכולת osteoregenerative עכבות עקב מחלה או גיל 7. גם אם מטופלים אינם איגודים בהצלחה, זה יכול לעלות בעודף של 60,000 $ להליך, בהתאם לסוג פציעה והגישות המועסקות 8.
במקרים מתונים, השתלת עצם אוטולוגית מועסקת. אסטרטגיה זו כרוכה בהחלמה של עצם מאתר תורם והשתלה באתר של פציעה. בעוד גישה זו היא מאוד יעילה, הנפח של עצם תורם נגזרות זמין מוגבל וההליך כרוך ניתוח נוסף, שתוצאתו כאב מתמשך בחולים רבים 9,10. בנוסף, היעילות של שתל עצם אוטולוגית תלויה של בריאותו של המטופל. תחליפי עצם עשויים מחומרים סינטטיים או עצם מגופות מעובד זמינים 11-13 בשפע, אבל הם חהve מגבלות משמעותיות, כוללים נכסים עניים הידבקות מארח תאים, osteoconductivity המופחת, והפוטנציאל לדחייה חיסונית 14. אין אפוא צורך דחוף בטכנולוגיות התחדשות עצם שבטוחות, יעילים וזמינות לציבור רחב.
היכולת שלנו לשפר את אסטרטגיות משובי עצם תלויה באופן קריטי על היכולת לחקות טראומת עצם חמורה בבעלי חיים בדיקה, אבל הדור והייצוב של נגעי עצם גדולים הוא מאתגר מבחינה טכנית. ברוב המקרים, טראומת עצם ארוך רצינית חיקתה בניסוי על ידי הקמת פגם שלא באופן טבעי לרפא. למרות שזה יכול להשתנות עם מינים 15, זו מושגת על ידי הסרת קטע עצם שהוא גדול יותר מ -1.5 פעמים הקוטר של עצם החתך 16 מלאה. העצם מכן התייצב עם שתל מתכת כדי לשמור על כיוון נכון של קצות שבר ולאפשר לניידות. בשל גודלם הקטן והשברירי שלהעצמות הארוכות שלהם, הקמת כזה נגעים בעכברים הן מעבר ליכולות של רוב קבוצות מחקר. ככזה, מודלים פגם עצם ארוך מוגבלים לחולדות ובעלי חיים גדולים יותר. עם זאת, עכברים יעניקו יתרונות משמעותיים במחקר שהם יכולים להיות מהונדסים גנטיים וגדלו כזנים שנפרץ חיסון שלא לדחות תאים ורקמות אנושיים.
עבור יישומים מבוססי תאים אנושיים, עכברים שנפרץ חיסון הם אטרקטיביים לעבוד איתו כי הם מבחינה פיזיולוגית מאופיינים היטב, קל לבית, חסכוני, בקלות ובנתח radiologically והיסטולוגיה. חשיבות עליונה הוא שעכברים שנפרץ חיסון לא דוחים תאים ממינים שונים כולל בני אדם. גודלם הקטן מאפשר גם הבדיקה של מספרים קטנים מאוד של תאים או כרכים של פיגומים ניסיוניים ביישומים אורטופדיים. כמה מודלים עכבריים אורתופדים כבר דיווחו כי להרשות לעצמו דרגות שונות של יציבות עצם 17,18. תוכנה לאלהms המוביל לרמות גבוהות מאוד של יציבות, כגון תופסנים חיצוניים וצלחות נעילה בעיקר לרפא על ידי התאבנות intramembranous למרות ריפוי endochondral דווח 19. בניגוד לכך, אלה המאפשרים כמה מיקרו ו / או מקרו-תנועה, כגון אלה המעסיקים סיכות לשדיות מבולבלות או חלקי-קבועות, בדרך כלל לרפא עם דומיננטיות של התאבנות endochondral 20,21. איגוד מושהה או פגמים שאינם איחוד של עצם ארוך הם קשה במיוחד להשגה בעכברים עקב הרמה נוספת של ייצוב הנדרשת. עם זאת, מספר גישות כבר דיווחו, כולל סיכות לשדיות עם ציפורני לובים, צלחות נעילה ותופסנים חיצוניים 22. מערכות אלה בדרך כלל עובדים היטב, אבל בהתחשב בעיצוב המסובך שלהם הם יכולים להיות מאתגרים מבחינה טכנית להתקנה. לדוגמא, גרסיה et al. 23 המציא מערכת סיכה שלובים אלגנטית לשימוש בעכברים, אבל ההליך כרוך חתכים בשני אתר נפרדים ושינוי נרחב של עצם הירך כדי להכיל את הסיכות. נהלים אלה בוצעו תחת מיקרוסקופ לנתח.
במסמך זה, אנו מתארים סיכה לשדית הירך פשוטה עם צווארון מרכזי שנועד למנוע סגירת גירעון עצם 3 מ"מ וגם להתוות את הקצוות המקוריים של הפגם. בעוד הסיכה לא הייתה קבועה לעצם עצמו, לשינוי גודל מדויק של קוטר הסיכה וreaming של תוצאות החלל הלשדיות בהתערבות מספיקה כדי למזער תנועת torsional (איור 1). עם בחירה זהירה של גיל טהור, מגדר ועכברים בהתאמה מתח, התוצאה היא שאינו uniondefect hypertrophic מאוד לשחזור 22 ניתן יהיה להעריך בקלות radiologically. יתר על כן אזורים של עניין יכולים להיות מוגדרים reproducibly לאחר טומוגרפיה-מחושב מיקרו (μCT) למדידת דה נובו היווצרות עצם ופרמטרי histomorphological. הסיכות היו prototyped במעבדה שלנו תוך שימוש בכלים זמינים.
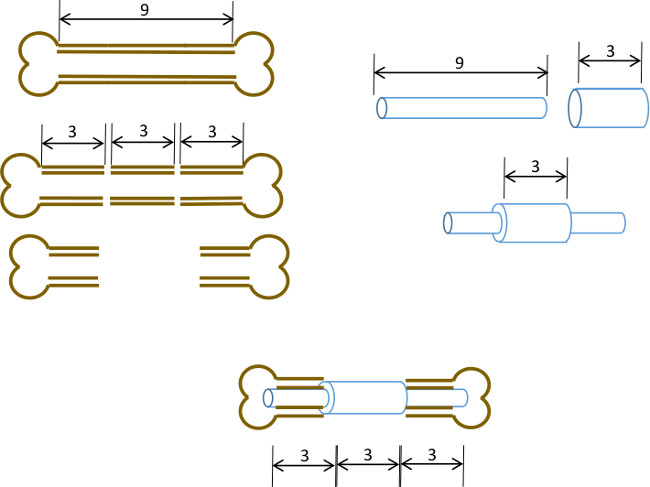
איור 1: עיקרון ניסויי סיכום תרשים של מודל הפגם המגזרי.. קטע 3 מ"מ המרכזי של עצם ירך עכברית 9-10 מ"מ הוא נכרת בניתוח (משמאל). צינור פלדה כירורגית ארוך 3 מ"מ, 19 מד הוא חלף על פני מ"מ ארוך 9, 22 צינור הנירוסטה G וקבוע עם דבק במרכז המדויק (מימין). סיכת התוצאה היא מצויד לתוך התעלות הלשדיות של החלקים הפרוקסימלית ודיסטלי הנותרים של עצם הירך עם 19 צווארון G החלפת קטע 3 מ"מ של עצם (להלן, במרכז).
Protocol
Representative Results
Discussion
בזאת, אנו מתארים שיטה פשוטה כדי ליצור פגם-התייצב סיכה קריטית בגודל של עצם הירך העכברית באמצעות מעבדה סטנדרטית וציוד וטרינרים. בעוד ההרכבה של הסיכות וההליך הכירורגי עצמו דורש תרגול, זה גם בתוך את היכולות של מדען מאומן היטב ביו-רפואי או מחקר וטרינר.
<p class="jove_content" style=";t…Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים לצוות וטרינרים במחלקת סקוט & White בית החולים השוואתי רפואה, בית המקדש, טקסס, לקבלת הייעוץ יסולא בפז שלהם וסיוע בפיתוח של טכניקה זו. עבודה זו מומנה בחלקו על ידי המכון למשובי קרנות תכנית לרפואה, סקוט & White RGP # מענק 90,172, NIH 2P40RR017447-07 וNIH R01AR066033-01 (NIAMS). אנו מודים לד"ר סוזן זיתוני לבידוד את כתב היד.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

