En enkel Kritisk stora Femoral Defect Model hos möss
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Det uppskattas att hälften av den amerikanska befolkningen upplever en fraktur vid en ålder av 65 1. För de patienter med frakturer behandlas kirurgiskt, 500.000 förfaranden innebär användning av en bentransplantation 2 och denna siffra väntas stiga med en alltmer åldrande befolkning 3 . Även ben är en av de få organ som har kapacitet att helt läka utan ärrbildning, det finns fall där processen misslyckas 3,4. Beroende på omständigheterna och behandlingskvalitet, 2-30% av långa benfrakturer misslyckas, vilket resulterar i icke-fackligt 3,5. Medan det fortfarande viss debatt om definition, pseudoartros, kritiska stora eller icke-fackligt benskador generellt hänvisar till en skada som inte läker över naturliga livslängd ämnet 6. I experimentsyfte, detta varaktighet förkortas till den genomsnittliga tid som krävs för fullständig läkning av en medelstor benskada. Icke fackliga benlesioner uppstå av numerous skäl, men viktiga faktorer inkluderar extrem trauma som resulterar i ett kritiskt stort gap, infektion, dålig angiogenes, tobaksbruk, eller hämmade osteoregenerative kapacitet på grund av sjukdom eller 7 års ålder. Även om icke-fackföreningarna framgångsrikt behandlas, kan det kosta över $ 60.000 per förfarande, beroende på typ av skada och de metoder som används 8.
I måttliga fall autolog bentransplantation anställd. Denna strategi innebär återvinning av ben från en donator webbplats och implantation på platsen för skadan. Även om detta tillvägagångssätt är extremt effektiv, är volymen av tillgänglig donator-derived ben begränsad och förfarandet innebär en ytterligare operation, vilket resulterar i ihållande smärta hos många patienter 9,10. Dessutom är effekten av den autologa bentransplantat beroende av patientens hälsa. Benersättningar gjorda av syntetmaterial eller bearbetat avliden ben finns i riklig mängd 11-13, men de HAve betydande begränsningar, inklusive dåliga värdcellsvidhäftningsegenskaper, reducerad osteokonduktivitet och potentialen för avstötning 14. Det finns därför ett akut behov för benuppbyggnad teknik som är säker, effektiv och allmänt tillgängliga.
Vår förmåga att förbättra ben regenerativa strategier är kritiskt beroende av förmågan att härma allvarlig skelettskada i försöksdjur, men generering och stabilisering av stora benlesioner är tekniskt utmanande. I de flesta fall är allvarliga rörben trauma härmas experimentellt genom att upprätta ett fel som inte kommer naturligt läka. Även om det kan variera med arter 15, uppnås detta genom fullständigt avlägsnande av ett ben segment som är större än 1,5 gånger diametern på benet tvärsnittet 16. Benet stabiliseras sedan med ett metallimplantat för att bibehålla korrekt orientering av brottkanter och möjliggöra rörlighet. På grund av sin ringa storlek och bräcklighetsina långa ben, inrättandet av sådana lesioner i möss är bortom kapaciteten hos de flesta forskargrupper. Som sådan är långa ben defekt modeller begränsas till råttor och större djur. Ändå möss ger betydande forskningsfördelar genom att de kan genetiskt modifierade och uppvuxna som immunkomprometterade stammar som inte förkastar mänskliga celler och vävnader.
För humana cellbaserade applikationer, immunkomprometterade möss är attraktivt att arbeta med eftersom de är fysiologiskt väldefinierad, lätt att huset, kostnadseffektivt och enkelt analyseras radiologiskt och histologiskt. Av största vikt är att immunkomprometterade möss inte avvisa celler från olika arter, inklusive människan. Deras ringa storlek tillåter också testning av ett mycket litet antal celler eller volymer experimentella byggnadsställningar i ortopediska applikationer. Flera murina ortopediska modeller har rapporterats att ge olika grader av ben stabilitet 17,18. De systemams som resulterar i mycket höga halter av stabilitet, såsom externa fixators och låsanplattor läka främst genom intramembranös benbildning trots endokondral läkning har rapporterats 19. Däremot de som tillåter vissa mikro- och / eller makro rörelse, till exempel de som använder ofixerade eller delvis fasta medullära stift, vanligen läker med en dominans av endokondral benbildning 20,21. Fördröjd union eller icke fackligt defekter av långa ben är särskilt svårt att uppnå i möss på grund av den extra nivå av stabilisering krävs. Dock har ett antal metoder rapporterats, inklusive märg stift med samverkande spikar, låsbara plattor och externa fixators 22. Dessa system fungerar i allmänhet väl, men med tanke på deras komplicerade konstruktion kan de vara tekniskt utmanande att installera. Till exempel, al. Garcia et 23 utarbetat en elegant samverkande stift för användning i möss, men förfarandet innebär snitt på två separat webbplatss och omfattande modifiering av lårbenet för att rymma stiften. Dessa procedurer utfördes under ett dissektionsmikroskop.
Häri beskriver vi en enkel lårbensmärg stift med en central krage utformats för att förhindra stängning av en 3 mm underskott ben och även beskriva de ursprungliga kanter defekten. Medan stiftet inte var fast till själva benet, att exakt dimensionering av stiftdiameter och brotschning av märghålan resulterar i tillräcklig interferens minimerar torsionsrörelse (Figur 1). Genom ett noggrant urval av inavlade ålder, kön och stam matchade möss, är resultatet en mycket reproducerbar hypertrofisk icke-uniondefect 22 som lätt kan utvärderas radiologiskt. Dessutom regioner av intresse kan reproducerbart definieras efter mikro datortomografi (μCT) för mätning av de novo benbildning och histomorphological parametrar. Stiften var prototyper i vårt laboratorium med hjälp av lättillgängliga verktyg.
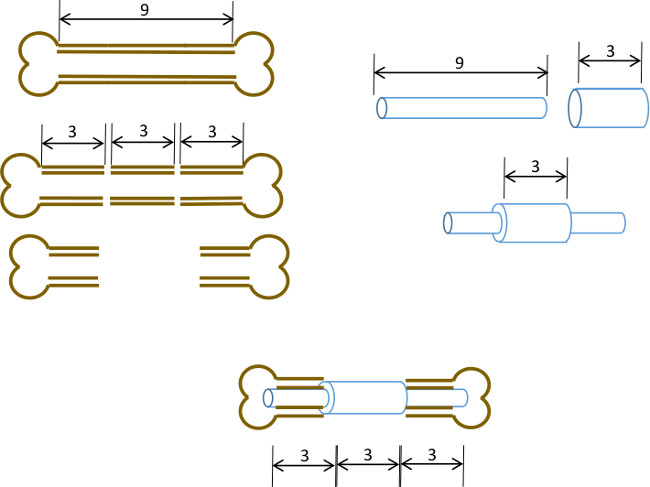
Figur 1: Experimentell princip Schematisk sammanfattning av den segmentdefekt modellen.. Det centrala 3 mm segment av en 9-10 mm murin lårben skärs kirurgiskt (vänster). En 3 mm långa, 19 gauge kirurgiskt stål röret bringas att passera över en 9 mm lång, 22 G-rostfritt stålrör och fixeras med bindemedel vid den exakta centrum (höger). Den erhållna stiftet är monterat i medullära kanalerna i de återstående proximala och distala delarna av lårbenet med 19 G kragen ersätter den 3 mm segment av ben (nedan, mitten).
Protocol
Representative Results
Discussion
Häri beskriver vi en enkel metod för att generera en kritisk storlek stift stabiliserade defekten av den murina lårbenet med användning av standardlaboratorie och veterinärmedicinsk utrustning. Medan montering av stiften och det kirurgiska ingreppet i sig kräver praktiken är det väl inom funktionerna i en välutbildad biomedicinsk forskare eller veterinär.
Stiftet placeras i medullära kanalen utan ytterligare fixering, vilket gör proceduren tekniskt mer genomförbart än mer kompl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar personalen och veterinärer på Scott & White Hospital Institutionen för medicin, Temple, Texas, för deras ovärderliga råd och hjälp under utvecklingen av denna teknik. Detta arbete har finansierats delvis av Institutet för regenerativ medicin Program fonder, Scott & White RGP bidrag # 90.172, NIH 2P40RR017447-07 och NIH R01AR066033-01 (NIAMS). Vi tackar Dr Suzanne Zeitouni för korrektur manuskriptet.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
References
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

