Anatomisk inspirerede tredimensionale mikrovæv-konstruerede neurale netværk til nervesystem rekonstruktion, modulering og modellering
Summary
Dette manuskript beskriver fremstillingen af mikrovæv-manipulerede neurale netværk: tredimensionale mikronstørrelseskonstruktioner bestående af langjusterede aksonale kanaler, der spænder over aggregerede neuronal populationer indkapslet i en rørformet hydrogel. Disse levende stilladser kan fungere som funktionelle relæer til rekonstruktion eller modulering af neurale kredsløb eller som biofideliske test-senge, der efterligner grå-hvid stof neuroanatomi.
Abstract
Funktionel opsving opstår sjældent efter skade eller sygdomsfremkaldt degeneration i centralnervesystemet (CNS) på grund af det hæmmende miljø og den begrænsede kapacitet til neurogenese. Vi udvikler en strategi til samtidig at behandle neuronal og axonal baneforløb inden for det beskadigede CNS. Dette manuskript præsenterer fremstillingsprotokollen for mikrovæv-manipulerede neurale netværk (mikro-TENNer), implanterbare konstruktioner bestående af neuroner og justerede axonale kanaler, der spænder over den ekstracellulære matrix (ECM) lumen af en præformeret hydrogelcylinder hundredvis af mikron i diameter, der kan strække sig centimeter i længden. Neuronal aggregater er afgrænset til ekstremerne af den tredimensionelle indkapsling og spændes af aksonale fremspring. Mikro-TENN'er er unikt justeret som en strategi for CNS rekonstruktion, emulerende aspekter af hjerne-forbindelse cytoarkitektur og potentielt tilvejebringe midler til netværksudskiftning. Den neuRonale aggregater kan synaps med værtsvæv til at danne nye funktionelle relæer til at genoprette og / eller modulere manglende eller beskadigede kredsløb. Disse konstruktioner kan også virke som proregenerative "levende stilladser", der er i stand til at udnytte udviklingsmekanismer til celle-migration og axonal pathfinding, der tilvejebringer synergistiske strukturelle og opløselige signaler baseret på regenereringstilstanden. Mikro-TENN'er fremstilles ved at hælde flydende hydrogel i en cylindrisk form indeholdende en langsgående centreret nål. Når hydrogelen har geleret, fjernes nålen og efterlader en hul mikrokolonne. En ECM-opløsning tilsættes til lumenet for at tilvejebringe et miljø egnet til neuronal vedhæftning og axonal udvækst. Dissocierede neuroner er mekanisk aggregeret til præcis podning i en eller begge ender af mikrokolonnen. Denne metode giver pålideligt selvstændige miniaturekonstruktioner med langt fremspringende aksonale kanaler, der kan genopbygge træk ved hjernens neuroanatomi. Synaptisk immUnolabeling og genetisk kodede kalciumindikatorer tyder på, at mikro-TENN'er har en omfattende synaptisk fordeling og iboende elektrisk aktivitet. Derfor repræsenterer mikro-TENN'er en lovende strategi for målrettet neurokirurgisk rekonstruktion af hjerneveje og kan også anvendes som biofideliske modeller til at studere neurobiologiske fænomener in vitro .
Introduction
En fælles karakteristika for lidelser og sygdomme i centralnervesystemet (CNS), såsom traumatisk hjerneskade (TBI), rygmarvsskade (SCI), slagtilfælde, Alzheimers sygdom og Parkinsons sygdom er afbrydelsen af aksonale veje og neuronale celler Tab 1 , 2 , 3 , 4 , 5 , 6 . For eksempel, når et iskæmisk slagtilfælde går ubehandlet, estimeres det, at axoner går tabt med en hastighed på 7 miles af axoner pr. Minut 5 . I tilfælde af TBI, som ca. 1,7 millioner mennesker oplever hvert år alene i USA, kan axonal degeneration fortsætte med at forekomme år efter traumer, da den oprindelige skade udfælder en langtids neurodegenerativ tilstand 4 . Forværring af disse skadelige virkninger har CNS en stærkt begrænset capaBy til regenerering 1 , 7 , 8 , 9 . Efter skader udvikler et hæmmende miljø, der er kendetegnet ved manglende rettet vejledning til fjerne mål, tilstedeværelsen af myelin-associerede inhibitorer, der forhindrer neuritudvæksten og dannelsen af et glialær ved reaktive astrocytter 8 , 10 , 11 , 12 . Glialæren tjener som en biokemisk og fysisk barriere for regenerering med molekyler som chondroitinsulfatproteoglycaner, der forhindrer axonudvækst 8 , 11 . Selvom neurale stamceller er blevet fundet i det voksne CNS, er produktionen af nye neuroner begrænset, da konsistente tegn på neurogenese kun er blevet fundet i lygtepæren, den hippocampaleSubgranulær zone, det periventrikulære område og den centrale kanal i rygmarven 13 , 14 . Disse hindringer forhindrer funktionel genopretning af tabte neuroner og hvid materiel arkitektur efter skade eller sygdom, hvilket resulterer i de ofte livsforandrende og langvarige virkninger af disse tilstande.
På trods af manglen på regenerativ kapacitet i det voksne CNS, er det blevet påvist, at axonal regenerering er mulig, hvis der fremlægges passende miljømærker til værtsneuroner 15 , 16 , 17 , 18 . Forskere har forsøgt at levere og manipulere vækstfaktorer ( fx nervevækstfaktor, epidermal vækstfaktor, glialafhængig vækstfaktor og neurotrofisk faktor-3) og andre vejledningsmolekyler til stimulering af plasticitet og axonregenerering 14 , </ Sup> 18 , 19 . Selv om disse undersøgelser har bekræftet, at voksne axoner er i stand til at reagere på vækstfaktorer, er disse strategier begrænset af den lave permeabilitet af blodhjernebarrieren og de specifikke rumlige og tidsmæssige gradienter, der kræves for at fremme regenerering 14 , 18 , 19 . Andre fremgangsmåder har påberåbt hyperaktiviteten af regenerationsrelaterede transkriptionsfaktorer i CNS neuroner. For eksempel stimulerede overekspression af stat3-transkriptionsfaktoren axonal regenerering i optisk nerve 20 . Ikke desto mindre undlader både biomolekylafgivelse og overekspression af transkriptionsfaktorer at erstatte tabte neuronale populationer. Cellebaserede strategier har hovedsageligt centreret om transplantation af neurale stamceller (NSC'er) i CNS, idet de udnytter deres evne til at erstatte CNS-neuroner, frigive trofiske faktorer,Og støtte de forsøg på neurogenese, der opstår efter skade 17 . På trods af dette er der stadig presserende udfordringer, der forhindrer denne tilgang, herunder transplanterede neurale cellers hæmmede evne til at overleve, integrere med værten og forbliver rumligt begrænset til det skadede område 6 , 14 , 17 , 21 . Desuden er celleafgivelse alene ude af stand til at genetablere cytoarkitekturen af beskadigede eller tabte axonale veje. En alternativ tilgang, der behandler problemerne med celle- og lægemiddel / kemikalieleveringsstrategier, kombinerer disse fremgangsmåder med anvendelsen af biomaterialerne 14 , 22 , 23 . Biomaterialer såsom hydrogeler er i stand til at emulere de biokemiske og fysiske egenskaber af den ekstracellulære matrix (ECM), der hjælper med celletilførsel ogD retention inden for det skadede område og levere vækstfaktorer og andre bioaktive molekyler med kontrolleret frigivelse 22 . De attraktive egenskaber ved disse biomaterialebaserede strategier har resulteret i beviser for in vivo axonal regenerering efter transplantation af stilladser til det læsionerede område 24 , 25 , 26 , 27 , 28 , 29 , 30 . Imidlertid erstatter acellulære biomaterialestrategier ikke tabte neuronale populationer; Når de anvendes som leveringskøretøjer til neuronale, glial- eller neuronale precursorceller, er biomaterialer ikke i stand til at rekonstituere langdistance-axonale netværk. Udfordringen med at udvikle en tilgang, der tackler både den axonale path degeneration og neuronale tab forbundet med CNS skade og sygdom er stadig <Sup class = "xref"> 31.
Vores forskergruppe har tidligere rapporteret udviklingen af implanterbare mikrovæv-manipulerede neurale netværk (mikro-TENN'er), som er en type "levende stillads" bestående af neuronelle celleorganer begrænset til en eller begge ender af en agarosehydrogel-ECM mikrosøjle , Med justerede aksonale kanaler, der strækker sig gennem det indre af denne tredimensionale (3D) indkapsling 1 , 10 , 31 , 32 . En af de største forskelle mellem denne teknik og tidligere tilgange er, at cytoarkitekturen af mikro-TENN'er er skabt helt in vitro og transplanteres bagefter 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . In vitro- fremstilling giver omfattende rumlig og tidsmæssig kontrol af cellulær fænotype og orientering, mekaniske / fysiske egenskaber, biokemiske signaler og eksogene faktorer, hvilket gavner værten efter integrationen af disse stilladser efter implantation 41 , 42 . Mikro-tenner er anatomisk inspireret, fordi de efterligner hjernens neuroanatomi, viser axonale kanaler, som ligner dem, der broerer de forskellige funktionelle regioner i hjernen ( figur 1A ) 1 . Derfor kan denne strategi være i stand til fysisk at erstatte tabte hvide stofkerner og neuroner efter implantation i en læsioneret region. Denne teknik er også inspireret af udviklingsmekanismer, hvor "naturlige levende stilladser" dannet af radiale glialceller og banebrydende axoner virker som vejledende guider for celleMigration fra subventriculær zone og aksonal udvækst, henholdsvis 43 . Disse mekanismer er rekapituleret i de justerede aksonale kanaler i mikro-TENN'er, som kan fremvise levende veje for neuralcellemigration og axonal regenerering ved axonformidlet aksonal udvækst ( figur 1C ) 43 . Desuden udnytter denne strategi fordel af synaptisk integration mellem mikro-TENN-neuronerne og det oprindelige kredsløb, der danner nye relæer, der kan bidrage til funktionel opsving ( figur 1B ) 43 . Kapaciteten til synapsdannelse kan også give denne tilgang evnen til at modulere CNS og reagere på værtsvæv ifølge netværksfeedback. For eksempel kan optogenetisk aktive neuroner i de levende stilladser stimuleres til at modulere værtsneuroner gennem synaptiske interaktioner ( figur 1D ).
Derudover vil den biomaterialebaserede rørformede konstrUgn af mikro-tenner giver et passende miljø til celleadhæsion, vækst, neuritilvækst og signalering, mens konstruktionernes miniaturedimensioner muliggør muligvis minimalt invasiv implantering og tilvejebringer en delvis sekvestreret mikromiljø for gradvis integration i hjernen. Faktisk har nyere publikationer vist potentialet hos mikro-tenner til at efterligne neurale veje efter implantation i rottehjerne. Efter stereotaxisk mikroinjektion rapporterede vi tidligere tegn på mikro-TENN-neuronal overlevelse, vedligeholdelse af aksonalkanalarkitektur og neurit forlængelse i værtscortex ud til mindst 1 måned in vivo 10 , 31 . Endvidere tilvejebragte mærkning med synapsin histologisk bevis for synaptisk integration med nativt væv 10 , 31 . Samlet set kan mikro-tennene være særligt velegnede til at rekonstruere og modulere beskadigedeCNS ved at erstatte tabte neuroner, synaptisk integrering med værts kredsløb, genoprette tabt aksonal cytoarkitektur og i visse tilfælde at tilvejebringe regenererende axoner med de relevante vejsøgningsindikatorer.
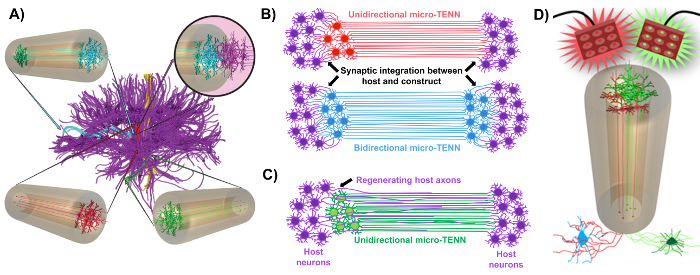
Figur 1: Principper og inspiration bag udviklingen af mikrovæv-manipulerede neurale netværk (mikro-tenner). ( A ) Mikro-TENN'er efterligner cytoarkitekturen i hjernekoblingen (lilla), hvor funktionelt adskilte regioner er forbundet med lange, justerede aksonale kanaler i en retningsretning (rød, grøn) eller tovejs (blå) måde. Som et eksempel kunne mikro-tenner rekonstruere tabte forbindelser i kortikothalamiske og nigrostriatale veje eller i den perforere vej fra entorhinal cortex til hippocampus (tilpasset fra Struzyna et al. , 2015) 1 . ( B ) Diagram af en ensrettet retningL og tovejs mikro-TENN (henholdsvis rød og blå) synaptisk integrering med værts kredsløb (lilla) for at fungere som et funktionelt relæ mellem begge ender af en læsion. ( C ) Skematisk af aksonale kanaler af en ensrettet mikro-TENN (grøn), der tjener som en vejledning til akson-faciliteret regenerering af værtsaksoner (lilla) mod et mål, som mikro-tennene interagerer med. ( D ) Konceptdiagram over brugen af optogenetisk aktive mikro-TENNS som neuromodulatorer, idet man udnytter synaptisk integration med excitatoriske eller hæmmende neuroner (bund). Klik her for at se en større version af denne figur.
Det nuværende manuskript beskriver den metode, der anvendes til fremstilling af mikro-TENN'er ved anvendelse af embryonalt afledte cerebrale kortikale neuroner. Især kan mikro-tenn fremstilles med andre typer af neurale celler. For eksempelDe oprindelige rapporter om succesfuld mikro-TENN-udvikling omfattede dorsale rodganglion (DRG) neuroner 32 . Hydrogelmikrokolonnerne kan genereres ( figur 2A ) ved tilsætning af flydende agarose til et skræddersyet, laserskæret cylindrisk kanalarray eller til kapillarrør, der begge indeholder indstillede akupunkturnåle. Nålen danner lumen og bestemmer mikrokolonnens indvendige diameter (ID), medens kapillarrørets ID og diameteren af cylindrene i den laserskårne anordning dikterer konstruktionernes ydre diameter (OD). OD og ID kan vælges ifølge den ønskede ansøgning ved at vælge forskellige diametre for henholdsvis anordning / kapillærrør og akupunktur nåle. Længden af mikrokolonnerne kan også varieres; Til dato har vi rapporteret opførelsen af mikro-tenner op til 20 mm i længden 10 og arbejder aktivt med længere længder. Efter agarosegelene og akupunkturen nEedler fjernes, en ECM-opløsning, som generelt består af type I-collagen, og laminin tilsættes til konstruktionens lumen ( figur 2C ). ECM-kernen tilvejebringer et stillads til understøttelse af neuronal celleadhæsion og axonal udvækst. I første omgang blev primære rottekortiske neuroner udpladet i mikrokolonnerne under anvendelse af dissocierede cellesuspensioner 10 , 31 , 32 . Denne fremgangsmåde producerede imidlertid ikke mål-cytoarkitekturen i alle tilfælde, som blev defineret som de neuronale cellelegemer, der var begrænset til enderne af mikrokolonnerne, med det centrale lumen bestående af renjusterede aksonale kanaler. Siden da har brugen af en tvungen neuronal aggregeringsmetode (baseret på protokoller tilpasset fra Ungrin et al .) Muliggjort en mere pålidelig og ensartet fremstilling af mikro-tenner med den ideelle struktur ( figur 2B ) 44 . Ud over at beskrive strømmenMetode, vil denne artikel vise repræsentative fasekontrast og konfokale billeder af mikro-TENN'er, der demonstrerer dannelsen af axonale kanaler over tid, såvel som den færdige mål-cytoarkitektur. Dette manuskript vil også udvide på bemærkelsesværdige aspekter af protokollen og de resterende udfordringer og fremtidige retninger af mikro-TENN teknologien.
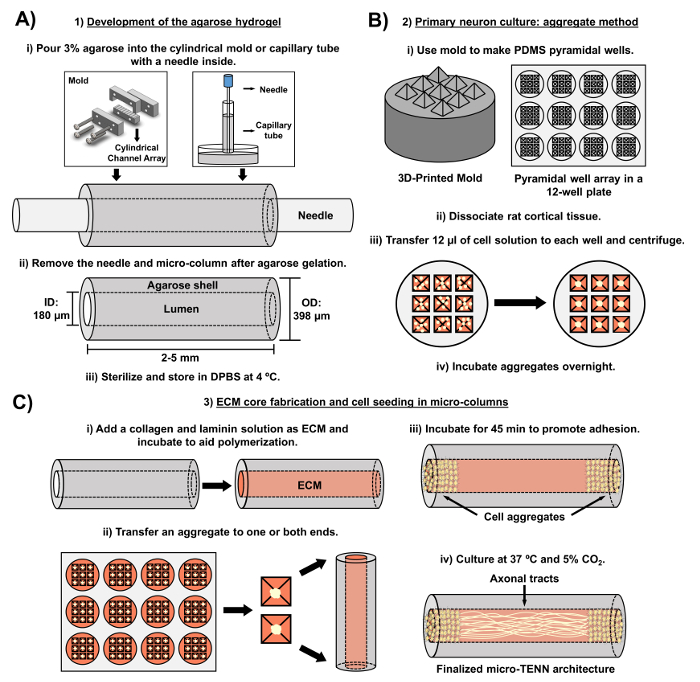
Figur 2: Skematisk diagram over tre-trins mikro-TENN fabrikationsprocessen. ( A ) Udvikling af agarosehydrogelen: (i) Indledningsvis indsættes en lille akupunkturnål ( f.eks . 180-350 μm i diameter) i en cylindrisk kanal af en skræddersyet laserskæret form eller et kapillarrør ( f.eks. , Diameter 380-700 μm). I det næste trin introduceres flydende agarose i DPBS i de cylindriske kanaler eller kapillarrør. (Ii) Efter agarosegelene fjernes nålen ogFormen er adskilt for at give de hule agarosemikolonner. (Iii) Disse konstruktioner steriliseres derefter og opbevares i DPBS. ( B ) Primær neuronkultur og aggregatmetoden: (i) Neuronal aggregering udføres i pyramidale mikrobrøndsarrayer, støbt fra 3D-trykte forme, der passer ind i brøndene på en 12-brønds kulturplade. (Ii) Mikro-TENN'er indbefatter primære rotte neuroner dissocieret fra føtalhjerner af embryonaldag-18 rotter. Efter vævsdissociation med trypsin-EDTA og DNase I fremstilles en celleopløsning med en densitet på 1,0-2,0 x 106 celler / ml. (Iii) 12 μl af denne opløsning overføres til hver brønd i den pyramide mikrobrøndsarray. Pladen indeholdende disse mikrobrønde centrifugeres for at fremstille celleaggregater. (Iv) Disse inkuberes derefter natten over inden plating i mikrokolonnerne. ( C ) ECM-kernefabrikation og celledannelse: (i) Forud for cellesædning blev en ECM-opløsning indeholdende 1 mg / ml type I-kollagen og 1 mg / mlLaminin overføres til det indre af mikro-tennene og får lov til at polymerisere. (Ii) Afhængigt af om ensrettet eller tovejs mikro-tenn fremstilles, anbringes et aggregat i henholdsvis en eller begge ekstremer af mikrokolonnen. (Iii) Efter en inkubationsperiode for at fremme vedhæftning dyrkes mikro-TENN i petriskåle oversvømmet med suppleret embryonalt neuronalt basalt medium. Iv) Efter 3-5 dage i dyrkning skal den endelige mikro-TENN-struktur demonstrere celleaggregater ved yderpunkterne af mikrokolonnen, med aksonale kanaler, der strækker sig over længden. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
CNS-skade og sygdom resulterer typisk i tab eller dysfunktion af de langsgående axonale veje, der omfatter hjernekoblet, med eller uden samtidig neuronal degenerering. Dette forværres af den begrænsede kapacitet af CNS til at fremme neurogenese og regenerering. På trods af udøvelsen af reparationsstrategier som vækstfaktor, celle og biomaterialetilførsel som individuelle eller kombinatoriske tilgange, undlader disse teknikker samtidig at tage hensyn til både degenerationen af neuronale celler og tabe…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Finansiel støtte blev ydet af National Institutes of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) og F31-NS090746 (Katiyar)), Michael J. Fox Foundation (Therapeutic Pipeline Program # 9998 (Cullen)), Penny Medicine Neuroscience Center Pilot Award (Cullen), National Science Foundation (Graduate Research fellowships DGE-1321851 (Struzyna og Adewole)), Department of Veterans Affairs (RR & D Merit Review # B1097-I (Cullen)), American Association Af neurologiske kirurger og kongres for neurologiske kirurger (Codman Society for Neurotrauma og Critical Care, 2015-2016) og US Army Medical Research and Materiel Command (# W81XWH-13-207004 (Cullen) og W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

