Sinir Sistemi Yeniden Yapılanma, Modülasyon ve Modelleme için Anatomik olarak İlham Almış Üç Boyutlu Mikro-Dokulu Mühendisli Sinir Ağları
Summary
Bu el yazması, mikro-doku ile tasarlanmış sinir ağlarının imalatını ayrıntılarıyla anlatmaktadır: boru biçiminde bir hidrojel içine konan agrega nöronal popülasyon (lar) yı kapsayan uzunlamasına hizalanmış aksonal yollardan oluşan üç boyutlu mikron boyutlu yapılar. Bu canlı iskele, sinirsel devreleri yeniden yapılandırmak veya modüle etmek için fonksiyonel röleler veya gri-beyaz madde nöroanatomisini taklit eden biyofiziksel test yatakları olarak işlev görebilir.
Abstract
Fonksiyonel düzelme nörojenez için inhibe edici ortam ve sınırlı kapasite nedeniyle merkezi sinir sistemi (MSS) içindeki yaralanma veya hastalığa bağlı dejenerasyon sonrasında nadiren oluşur. Hasar gören SSS'de nöronal ve aksonal yol kaybını aynı anda gidermek için bir strateji geliştiriyoruz. Bu el yazması, mikro-doku mühendislik yapmış sinir ağları (mikro-TENN'ler), implante edilebilen nöronlar ve santimetre uzayabilen yüzlerce mikron çapında önceden oluşturulmuş bir hidrojel silindirin hücre dışı matrisi (ECM) lümenine hizalı aksonal yollardan oluşan implantasyon yapım protokolünü sunmaktadır uzunluğunda. Nöronal agregalar üç boyutlu kaplamanın uçlarına sınırlanır ve aksonal projeksiyonlarla yayılır. Micro-TENN'ler CNS yeniden yapılandırması için bir strateji olarak benzersiz bir konumdadır ve beyin bağlantılı sitrik mimarisinin özelliklerini taklit eder ve potansiyel olarak ağ değişimi için araçlar sağlar. NeuRonal agregalar eksik veya hasar görmüş devreyi restore etmek ve / veya modüle etmek için yeni fonksiyonel röleler oluşturmak üzere konakçı doku ile sinapslanabilir. Bu yapılar ayrıca, hücre yenilemesi ve aksonal yol bulma için gelişim mekanizmalarını kullanabilen, rejenerasyon durumuna dayanan sinerjik yapısal ve çözünür ipuçları sağlayan pro-rejeneratif "canlı iskele" olarak da işlev görebilir. Mikro-TENN'ler sıvı hidrojel, uzunlamasına merkezli bir iğne içeren silindirik bir kalıba dökülüp imal edilir. Hidrojel jelleştikten sonra iğne boşaltılarak içi boş bir mikro sütun bırakılarak çıkarılır. Nöronal yapışma ve aksonal gelişim için uygun bir ortam sağlamak için lümene bir ECM çözeltisi eklenir. Ayrışmış nöronlar, mikro sütunun bir veya iki ucunda hassas tohumlama için mekanik olarak toplanır. Bu metodoloji, beyin nöroanatomisinin özelliklerini yineleyebilecek uzun projeksiyonlu aksonal yollar içeren kendi kendine yeten minyatür yapıları güvenilir bir şekilde üretir. Synaptic immEtiketsiz ve genetik olarak kodlanmış kalsiyum göstergeleri, mikro-TENN'lerin kapsamlı sinaptik dağılımına ve elektriksel aktiviteye sahip olduğunu ortaya koymaktadır. Sonuç olarak, mikro-TENN'ler, beyin yolaklarının hedefe yönelik nöroşirürji rekonstrüksiyonu için umut verici bir stratejiyi temsil eder ve nörobiyolojik olayları in vitro olarak incelemek için biyo-fidelik modeller olarak da uygulanabilir.
Introduction
Travmatik beyin hasarı (TBI), omurilik yaralanması (SCI), inme, Alzheimer hastalığı ve Parkinson hastalığı gibi merkezi sinir sistemi hastalıklarının (MSS) ortak bir özelliği, aksonal yolların ve nöronal hücrenin kopukluğudur Kayıp 1 , 2 , 3 , 4 , 5 , 6 . Örneğin, iskemik bir inme tedavi edilmezse, aksonların dakikada 7 mil akson hızında kaybolduğu tahmin edilir. Her yıl yaklaşık 1.7 milyon insanın her yıl ABD'de deneyimlediği TBI vakasında, aksonal bozulmalar travmadan sonra yıllar sonra devam edebilir, çünkü ilk hasar uzun vadede nörodejeneratif bir duruma neden olur 4 . Bu zararlı etkileri ağırlaştıran MSS ciddi ölçüde sınırlı bir kapaa sahiptirRejenerasyon için şehir 1 , 7 , 8 , 9 . Yaralanmadan sonra, uzak hedeflere yöneltilen rehberlik eksikliği, nörit büyümesini engelleyen miyelin ile ilişkili inhibitörlerin varlığı ve reaktif astrositler 8 , 10 , 11 , 12 tarafından bir glial skar oluşumu ile karakterize bir inhibitör ortam gelişir. Glial skar, yenilenmeye karşı biyokimyasal ve fiziksel bir bariyer görevi görür ve kondroitin sülfat proteoglikanlar gibi akson büyümesini engelleyen moleküller bulunur 8 , 11 . Dahası, yetişkin MSS'de sinir kök hücreleri bulunsa da, yeni nöronların üretimi sınırlıdır çünkü tutarlı nevrojenez bulgusu yalnızca koku alma ampulünde, hipokampalde bulunurSubgranular bölge, periventriküler alan ve omuriliğin merkezi kanalı 13 , 14 . Bu engeller, yaralanma ya da hastalığın ardından kayıp nöronların ve beyaz cevher mimarisinin işlevsel olarak iyileştirilmesini önler ve bu durumların yaşamı değişen ve uzayan etkileriyle sonuçlanır.
Yetişkin MSS'de rejeneratif kapasitenin olmamasına rağmen, konakçı nöronlarına 15 , 16 , 17 , 18 yeterli çevresel ipuçları verildiğinde aksonal rejenerasyonun mümkün olduğu gösterilmiştir. Araştırmacılar, büyüme faktörlerini ( örn., Sinir büyüme faktörü, epidermal büyüme faktörü, glial bağımlı büyüme faktörü ve nörotrofik faktör-3) ve diğer rehberlik moleküllerini, plastisite ve akson rejenerasyonunu uyarmak için sunmaya ve bunları manipüle etmeye teşebbüs ettiler14 ,/ Sup> 18 , 19 . Bu çalışmalar yetişkin aksonların büyüme faktörlerine cevap verebildiklerini doğrulasa da, bu stratejiler, kan-beyin bariyerinin düşük permeabilitesi ve rejenerasyonu teşvik etmek için gereken spesifik uzaysal ve zamansal gradyanlar ile sınırlandırılmıştır 14,18,19. Diğer yaklaşımlar, CNS nöronlarında rejenerasyona bağlı transkripsiyon faktörlerinin hiperaktivasyonuna dayanmaktadır. Örneğin, Stat3 transkripsiyon faktörünün aşırı ekspresyonu optik sinir 20'de aksonal rejenerasyonu uyardı. Bununla birlikte, hem biyomolekülün verilmesi hem de transkripsiyon faktörlerinin aşırı ekspresyonu kayıp nöronal popülasyonların yerini alamaz. Hücre temelli stratejiler esas olarak merkezi sinir sistemi kök hücrelerine (CNS nöronları) yer değiştirme kapasitelerinden yararlanarak merkezi sinir sistemi kök hücrelerine (NSC) nakledilmeyi, trofik faktörleri serbest bırakmayı,Ve yaralanma sonrası meydana gelen nörojenez girişimlerini desteklemek 17 . Buna rağmen, transplante nöral hücrelerin hayatta kalma, konakçıya entegre olma ve fiziksel olarak yaralı bölgeye 6 , 14 , 17 , 21 ile sınırlı kalma gibi engellenmiş yetenekleri de içeren bu yaklaşımı engelleyen zorlayıcı zorluklar hala var. Buna ek olarak, hücre iletiminin tek başına hasar görmüş ya da kaybolmuş aksonal yolların sitrik mimarisini eski haline getirememesi mümkündür. Hücre ve ilaç / kimyasal dağıtım stratejilerinin karşılaştığı problemleri ele alan alternatif bir yaklaşım, bu yaklaşımları biyomalzemelerin 14 , 22 , 23 kullanımı ile birleştirmektir. Hidrojenler gibi biyomalzemeler, hücre dışına matrisin (ECM) biyokimyasal ve fiziksel özelliklerini öykünme yeteneğine sahiptir ve hücre dağıtımına yardımcı olur veD sakat bölgede tutulması ve kontrollü salınımlı büyüme faktörleri ve diğer biyoaktif moleküller sağlanması 22 . Bu biyo materyal temelli stratejilerin çekici özellikleri, iskeleleri lezyon alanına 24 , 25 , 26 , 27 , 28 , 29 , 30 nakledildikten sonra in vivo aksonal rejenerasyon kanıtıyla sonuçlanmıştır. Bununla birlikte, hücresel olmayan biyomalzeme stratejileri kayıp nöronal popülasyonların yerini tutmaz; Nöronal, glial veya nöronal öncü hücreler için iletim araçları olarak kullanıldığında, biyomalzemeler uzun mesafeli aksonal ağları yeniden yapılandıramazlar. Hem aksonal patikada bozulma, hem de MSS hasarı ve hastalığına bağlı nöronal kaybı ele alan bir yaklaşım geliştirmenin zorluğu <Sup class = "xref"> 31.
Araştırma grubumuz, bir agaroz hidrojel-ECM mikro sütununun bir veya her iki ucuyla sınırlandırılmış nöronal hücre cisimciklerinden oluşan bir "canlı iskelet" türü olan implante edilebilir mikro doku mühendislik sinir ağlarının (mikro-TENN'lerin) gelişimini daha önce rapor etmiştir , Bu üç boyutlu (3D) kaplamanın 1 , 10 , 31 , 32 iç kısmı boyunca uzanan hizalı aksonal yollarla birlikte. Bu teknik ile daha önceki yaklaşımlar arasındaki temel farklardan biri, mikro-TENN'lerin sitolojisinin in vitro olarak tamamen oluşturulduğu ve daha sonra 33 , 34 , 35 , 36 , 37 , 38 ,Sup class = "xref"> 39 , 40 , 41 . In vitro üretim, hücre iskeletinin ve oryantasyonunun, mekanik / fiziksel özelliklerin, biyokimyasal ipuçlarının ve eksojen faktörlerin kapsamlı mekansal ve zamansal kontrolünü sağlar ve implantasyon sonrası konakçıya bu iskeletlerin entegrasyonunu sağlar 41,42. Mikro-TEN'ler anatomik olarak esinlenmiştir, çünkü beyin nöroanatomisini taklit ederler, beyindeki farklı işlevsel bölgelere köprü yapanlara benzer aksonal yollar görüntüler ( Şekil 1A ) 1 . Bu nedenle, bu strateji lezyonlu bir bölgeye implantasyon sonrası kaybedilen beyaz cevher yollarını ve nöronları fiziksel olarak değiştirebilir. Bu teknik aynı zamanda radyal glial hücreler ve öncü aksonlar tarafından oluşturulan "doğal canlı iskele" nin hücre için yol bulma kılavuzları rolündeki gelişim mekanizmalarından esinlenmiştir.Subventriküler bölgeden göç ve aksonal büyüme, sırasıyla 43 . Bu mekanizmalar, akson aracılı aksonal büyümeyle ( Şekil 1C ) nöral hücre göçü ve aksonal rejenerasyon için canlı yollar sunabilen mikro-TENN'lerin hizalı aksonal yollarında tekrarlar. Dahası, bu strateji, mikro-TENN nöronları ve doğal devre arasındaki sinaptik bütünleşmeden yararlanarak işlevsel toparlanmaya katkıda bulunabilecek yeni röleler oluşturur ( Şekil 1B ) 43 . Sinaps oluşumu kapasitesi, bu yaklaşıma, MSS'yi modüle etme ve ağ geri bildirimine göre ev sahibi dokuya yanıt verme becerisi de verebilir. Örneğin canlı iskele içindeki optogenetik olarak aktif nöronlar, sinaptik etkileşimler yoluyla konakçı nöronlarını modüle etmek için uyarılabilir ( Şekil 1D ).
Buna ek olarak, biyomalzeme esaslı boru şekilli konstrüksiyonMikro-TENN'lerin kullanılması yapıların minyatür boyutları, minimal invaziv implantasyona izin verir ve kademeli olarak beyne entegrasyon için kısmen kenetlenmiş bir mikro ortam sağlarken hücre yapışması, büyüme, nevrit ekspansiyonu ve sinyalizasyon için uygun bir ortam sunar. Nitekim, son yayınlar sıçan beynine yerleştirildikten sonra mikro-TEN'lerin sinir yollarını taklit etme potansiyeli olduğunu göstermiştir. Stereotaksik mikroenjeksiyon sonrasında daha önce, mikro-TENN nöronal sağkalımı, aksonal bölge mimarisi bakımından ve konakçı kortekse in vivo 10 , 31 en az 1 ay boyunca nörit uzatmanın kanıtlarını bildirdik. Dahası, synapsin ile etiketleme, doğal doku 10,31 ile sinaptik entegrasyonun histolojik kanıtı sağladı. Genel olarak, mikro-TENN'ler, hasarın yeniden yapılandırılması ve modülasyonu için benzersiz şekilde uygun olabilirKaybedilmiş nöronları değiştirerek, ana devre ile sinaptik olarak bütünleşerek, kaybedilen aksonal sitolojiyi geri yükleyerek ve bazı durumlarda uygun yol bulma ipuçlarını içeren yenilenen aksonları sağlayarak MSS.
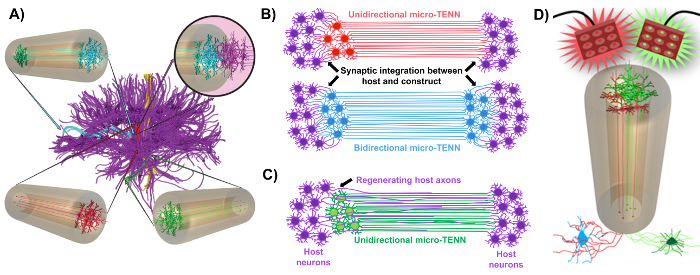
Şekil 1: Mikro-doku ile tasarlanmış sinir ağı (mikro-TEN) gelişimi arkasındaki ilkeler ve ilham. ( A ) Mikro-TENN'ler işlevsel olarak farklı bölgelerin tek yönlü (kırmızı, yeşil) veya iki yönlü (mavi) şekilde uzun, hizalanmış aksonal yollarla bağlandığı beynin bağlanmasını (mor) simüle eder. Örnek olarak, mikro-TENN'ler, kortikotalamik ve nigrostriatal yollarda veya entorinal korteksten hipokampusa (struzyna ve diğerleri, 2015'den adapte edilmiş) perforant yolda kaybedilen bağlantıları yeniden oluşturabilir 1 . ( B ) Tek yönlü bir diyagramL ve her lezyonun her iki ucu arasında fonksiyonel bir röle olarak görev yapmak üzere ana devre (mor) ile sinaptik olarak entegre olan çift yönlü mikro-TENN (sırasıyla kırmızı ve mavi). ( C ) Mikro-TENN'in etkileşimde bulunduğu bir hedefe doğru ana aksonların (mor) akson kolaylaştırılmış rejenerasyonu için bir kılavuz olarak hizmet eden, tek yönlü bir mikro-TENN'in (yeşil) aksonal yollarının şeması. ( D ) Neşredici veya inhibe edici nöronlar (alt) ile sinaptik entegrasyon yararlanarak, nöromodülatörler olarak optogenetik olarak aktif mikro-TENNS kullanımı kavramsal diyagram. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Mevcut el yazması, embriyonik olarak türetilen serebral kortikal nöronları kullanarak mikro-TEN'lerin imalinde kullanılan metodolojiyi ayrıntılarıyla anlatmaktadır. Özellikle, mikro-TEN'ler diğer nöral hücreler türleriyle birlikte üretilebilir. Eski içinBaşarılı, mikro-TENN gelişiminin ilk raporlarında sırt kök gangliyon (DRG) nöronları 32 bulunmaktadır. Hidrojel mikro sütunları, sıvı ile şekillendirilmiş, lazerle kesilmiş bir silindirik kanal dizisine veya kılcal tüplere, her ikisi de hizalı akupunktur iğnelerini içeren sıvı agaroz eklenerek üretilebilir ( Şekil 2A ). İğne lümeni oluşturur ve mikro-kolonun iç çapını (ID) belirler; buna karşın kılcal tüp ID'si ve lazer kesme cihazındaki silindirlerin çapı yapıların dış çapını (OD) belirler. OD ve ID, sırasıyla, cihaz / kılcal tüpler ve akupunktur iğneleri için farklı çaplar seçerek istenen uygulamaya göre seçilebilir. Mikro kolonların uzunluğu da değiştirilebilir; Bugüne kadar, uzunluğu 20 mm'ye kadar olan mikro-TEN'lerin yapımını bildirdik ve aktif olarak daha uzun uzunluklarda ilerliyoruz. Agaroz jellerinden ve akupunkturdan sonra nEedles kaldırılır, genellikle tip I kollajen ve laminin içeren bir ECM çözeltisi yapıların lümenine eklenir ( Şekil 2C ). ECM çekirdeği, nöronal hücre yapışmasını ve aksonal gelişimini desteklemek için bir iskelet sağlar. Başlangıçta, primer sıçan kortikal nöronları, ayrılmış hücre süspansiyonları 10 , 31 , 32 kullanılarak mikro-kolonlara kaplandı. Bununla birlikte, bu yaklaşım, merkezi lümen saf hizalanmış aksonal yollardan oluşan, mikro kolonların uçlarıyla sınırlı nöronal hücre cisimcikleri olarak tanımlanan her durumda hedef cyto mimari yapı oluşturmadı. O günden bu yana, (Ungrin ve arkadaşlarının uyarladığı protokollere dayalı olarak) zorlanmış bir nöronal toplama yönteminin kullanılması, ideal yapı ( Şekil 2B ) 44 ile daha güvenilir ve tutarlı bir mikro-TENN imalatı sağlamıştır. Mevcut durumu tanımlamanın yanı sıraMetodoloji ile bu makalede zamanla aksonal yolların oluşumunu gösteren mikro-TENN'lerin temsili faz kontrastı ve konfokal görüntülerinin yanı sıra sonuçlandırılmış hedef hücre mimarisi de gösterilecektir. Bu el yazması, protokolün kayda değer yönleri ve kalan teknolojilerin ve gelecekteki mikro-TENN teknolojisinin yöneliminde de genişleyecektir.
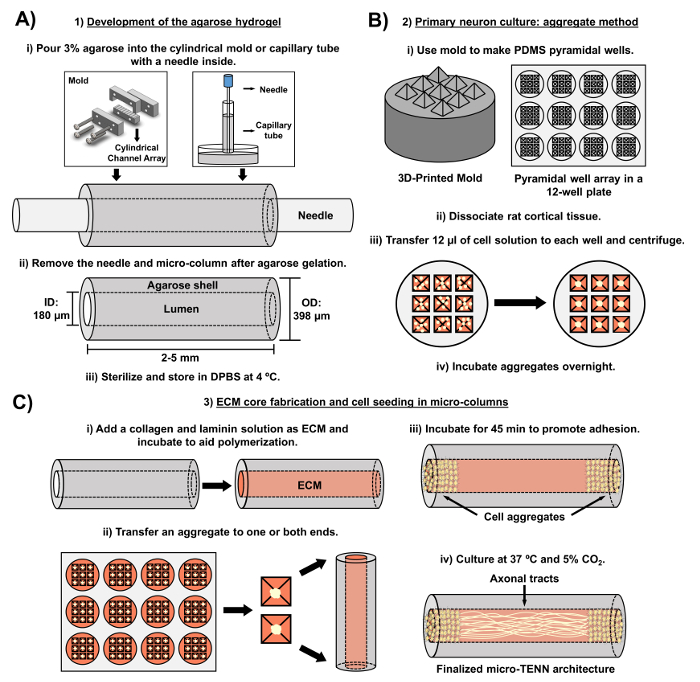
Şekil 2: Üç aşamalı mikro-TENN imalat sürecinin şematik diyagramı. ( A ) Agaroz hidrojelinin gelişimi: (i) Başlangıçta, küçük bir akupunktur iğnesi ( örn. , 180-350 μm çapında), ısmarlama lazerle kesilmiş kalıp veya kılcal borunun silindirik kanallarına yerleştirilir ( örn. , 380-700 μm çapında). Bir sonraki adımda, DPBS içindeki sıvı agaroz silindirik kanallara veya kılcal tüplere sokulur. (Ii) Agaroz jellerinden sonra, iğne çıkarılır veKalıp boşaltılmış agaroz mikro sütunları elde etmek için söküldü. (Iii) Bu yapılar daha sonra sterilize edilir ve DPBS'de saklanır. ( B ) Primer nöron kültürü ve agrega yöntemi: (i) Nöronal agregasyon, 12-çukurlu bir kültür plakasının oyuklarına uyan 3D baskılı kalıplardan dökülen piramidal mikro-kuyu dizilerinde gerçekleştirilir. (Ii) Mikro-TENN'ler, embriyonik-gün-18 sıçanların fetal beyinlerinden ayrılan birincil sıçan nöronlarını içerir. Tripsin-EDTA ve DNaz I ile doku ayrışmasının ardından, 1.0-2.0 x 106 hücre / mL yoğunluğa sahip bir hücre çözeltisi hazırlanır. (Iii) Bu çözeltiden 12 uL, piramidal mikro-kuyu dizisindeki her kuyuya aktarılır. Bu mikro kuyuları içeren plaka, hücre agregaları üretmek üzere santrifüje tabi tutulur. (Iv) Bunlar daha sonra mikro-kolonlara kaplamadan önce gece boyunca inkübe edilir. ( C ) ECM çekirdek imalatı ve hücre tohumlaması: (i) Hücre tohumlamadan önce, 1 mg / mL tip I kollajen ve 1 mg / mLLaminin, mikro-TENNlerin içine aktarılır ve polimerize olmasına izin verilir. (Ii) Tek yönlü veya çift yönlü mikro-TEN'lerin imal edilip edilmediklerine bağlı olarak, bir agrega sırasıyla mikro-kolonun bir veya her iki ucuna yerleştirilir. (Iii) Yapışma kabiliyetini arttırmak için inkübasyon süresinin ardından, mikro-TENN'ler eklenmiş embriyonik nöronal bazal ortam ile sızdırılmış Petri kaplarında kültürlenir. (Iv) Kültürde 3-5 gün sonra nihai mikro-TENN yapısı, akson kanallarının uzunluğunu uzatarak mikro kolonun uçlarında hücre agregalarını göstermelidir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Protocol
Representative Results
Discussion
CNS yaralanması ve hastalığı tipik olarak, birlikte görülen nöronal dejenerasyon ile veya olmadan, beyin connectome'yu içeren uzun mesafeli aksonal yolların kaybedilmesi veya işlevinde aksama ile sonuçlanır. Bu nörojenez ve yenilenmeyi teşvik etmek için CNS'in sınırlı kapasitesi ile karışıktır. Bireysel veya kombinatoryal yaklaşımlar olarak büyüme faktörü, hücre ve biyomalzeme sunumu gibi onarım stratejilerinin peşinde olmasına rağmen, bu teknikler aynı anda hem nöronal hücrel…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Mali destek, Michael J. Fox Vakfı (Terapötik Boru Hattı Programı # 9998 (Cullen)), Ulusal Sağlık Enstitüleri U01-NS094340 (Cullen), T32-NS043126 (Harris) ve F31-NS090746 (Katiyar)) tarafından sağlandı. (Cullen), Penn Sciences Neuroscience Merkezi Pilot Ödülü (Cullen), Ulusal Bilim Vakfı (Yüksek Lisans Araştırma Bursu DGE-1321851 (Struzyna ve Adewole)), Gazi İşleri Departmanı (RR & D Merit İncelemesi # B1097-I (Cullen)), Amerikan Derneği Nörolojik Cerrahlar Kongresi ve Nörolojik Cerrahlar Kongresi (2015-2016 Nörotravma ve Kritik Bakımda Kod Adam Bursu (Petrov)) ve ABD Ordusu Tıbbi Araştırma ve Materiel Komutanlığı (# W81XWH-13-207004 (Cullen) ve W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

