Anatomisch inspirierte dreidimensionale Mikro-Gewebe-konstruierte Neuronale Netze für Nervensystem-Rekonstruktion, Modulation und Modellierung
Summary
Dieses Manuskript beschreibt die Herstellung von mikrogewebetechnischen neuronalen Netzen: dreidimensionale mikrometergroße Konstrukte, die aus lang ausgerichteten axonalen Traktaten bestehen, die aggregierte neuronale Populationen umfassen, die in einem tubulären Hydrogel umhüllt sind. Diese lebenden Gerüste können als funktionelle Relais dienen, um neuronale Schaltkreise zu rekonstruieren oder zu modulieren oder als biofidelische Testbetten, die grau-weiße Materie Neuroanatomie nachahmen.
Abstract
Die funktionelle Erholung tritt nach der Verletzung oder der krankheitsinduzierten Degeneration im zentralen Nervensystem (ZNS) aufgrund der hemmenden Umgebung und der begrenzten Neurogenesefähigkeit häufig auf. Wir entwickeln eine Strategie, um gleichzeitig den neuronalen und axonalen Wegverlust innerhalb des beschädigten ZNS zu adressieren. Dieses Manuskript stellt das Herstellungsprotokoll für Mikrogewebe-konstruierte neuronale Netze (Mikro-TENNs) dar, implantierbare Konstrukte, bestehend aus Neuronen und ausgerichteten axonalen Traktaten, die das extrazelluläre Matrix- (ECM-) Lumen eines vorgeformten Hydrogelzylinders umhängen, der Hunderte Mikrometer Durchmesser aufweist, der sich in Zentimeter erstrecken kann in Länge. Neuronale Aggregate sind auf die Extreme der dreidimensionalen Umhüllung abgegrenzt und werden durch axonale Projektionen überspannt. Micro-TENNs sind einzigartig als Strategie für den ZNS-Rekonstruktion, emulieren Aspekte der Gehirn-Connectome-Cytoarchitektur und potenziell Bereitstellung von Mitteln für den Netzaustausch. Die neuRonale Aggregate können mit Wirtsgewebe synapsen, um neue funktionale Relais zu bilden, um fehlende oder beschädigte Schaltkreise wiederherzustellen und / oder zu modulieren. Diese Konstrukte können auch als proregenerative "lebende Gerüste" fungieren, die in der Lage sind, Entwicklungsmechanismen für die Zellmigration und die axonale Pfadfindung zu nutzen, wobei synergistische strukturelle und lösliche Cues auf der Grundlage des Regenerationszustandes vorhanden sind. Mikro-TENNs werden hergestellt, indem flüssiges Hydrogel in eine zylindrische Form gegossen wird, die eine in Längsrichtung zentrierte Nadel enthält. Sobald das Hydrogel geliert ist, wird die Nadel entfernt, wobei eine hohle Mikrosäule zurückbleibt. Eine ECM-Lösung wird dem Lumen zugesetzt, um eine Umgebung bereitzustellen, die für neuronale Adhäsion und axonales Auswachsen geeignet ist. Dissoziierte Neuronen werden für eine präzise Aussaat innerhalb eines oder beider Enden der Mikrosäule mechanisch aggregiert. Diese Methodik produziert zuverlässig selbständige Miniatur-Konstrukte mit langprojektiven axonalen Traktaten, die Merkmale der Hirnneuroanatomie rekapitulieren können. Synaptic immUnauffällige und genetisch codierte Calciumindikatoren deuten darauf hin, dass Mikro-TENNs eine weitgehende synaptische Verteilung und intrinsische elektrische Aktivität besitzen. Folglich stellen Mikro-TENNs eine vielversprechende Strategie für eine gezielte neurochirurgische Rekonstruktion von Gehirnwegen dar und können auch als biofidelische Modelle zur Untersuchung neurobiologischer Phänomene in vitro angewendet werden .
Introduction
Ein gemeinsames Merkmal von Erkrankungen und Erkrankungen des Zentralnervensystems (ZNS), wie z. B. traumatische Hirnverletzungen (TBI), Rückenmarksverletzungen (SCI), Schlaganfall, Alzheimer-Krankheit und Parkinson-Krankheit, ist die Trennung von axonalen Bahnen und neuronaler Zelle Verlust 1 , 2 , 3 , 4 , 5 , 6 . Zum Beispiel, wenn ein ischämischer Schlaganfall unbehandelt wird, wird geschätzt, dass Axone mit einer Rate von 7 Meilen von Axonen pro Minute 5 verloren gehen. Im Falle von TBI, die etwa 1,7 Millionen Menschen jedes Jahr in den USA alleine erleben, kann die axonale Degeneration auch nach dem Trauma weiter auftreten, da die anfängliche Verletzung einen langfristigen neurodegenerativen Zustand auslöst 4 . Diese schädlichen Wirkungen verschärfen, hat das ZNS eine stark eingeschränkte KapazitätStadt zur Regeneration 1 , 7 , 8 , 9 . Nach der Verletzung entwickelt sich eine hemmende Umgebung, die durch einen Mangel an gerichteter Orientierung an entfernten Targets, die Anwesenheit von Myelin-assoziierten Inhibitoren, die das Auswachsen von Neuriten behindern, und die Bildung einer Glia-Narbe durch reaktive Astrozyten 8 , 10 , 11 , 12 gekennzeichnet ist . Die gliale Narbe dient als biochemische und physikalische Barriere gegen die Regeneration, wobei Moleküle wie Chondroitinsulfat-Proteoglykane das Axonwachstum 8 , 11 behindern. Darüber hinaus, obwohl neuronale Stammzellen in der erwachsenen ZNS gefunden worden sind, ist die Produktion von neuen Neuronen begrenzt, da konsequente Hinweise auf Neurogenese wurde nur in der olfaktorischen Glühbirne, die Hippocampal gefundenSubgranulare Zone, die periventrikuläre Fläche und der zentrale Kanal des Rückenmarks 13 , 14 . Diese Hindernisse verhindern die funktionelle Wiederherstellung von verlorenen Neuronen und der weißen Stoffarchitektur nach Verletzung oder Krankheit, was zu den oft lebensverändernden und verlängerten Wirkungen dieser Bedingungen führt.
Trotz des Mangels an regenerativer Kapazität im adulten ZNS wurde gezeigt, dass eine axonale Regeneration möglich ist, wenn den Wirtsneuronen 15 , 16 , 17 , 18 adäquate Umgebungsmerkmale präsentiert werden. Forscher haben versucht, Wachstumsfaktoren zu liefern und zu manipulieren ( zB Nervenwachstumsfaktor, epidermaler Wachstumsfaktor, glialabhängiger Wachstumsfaktor und neurotrophischer Faktor-3) und andere Leitmoleküle zur Stimulierung von Plastizität und Axonregeneration 14 , </ Sup> 18 , 19 Obwohl diese Studien bestätigt haben, dass erwachsene Axone in der Lage sind, auf Wachstumsfaktoren zu reagieren, sind diese Strategien durch die geringe Permeabilität der Blut-Hirn-Schranke und die spezifischen räumlichen und zeitlichen Gradienten, die zur Förderung der Regeneration 14 , 18 , 19 erforderlich sind, begrenzt. Andere Ansätze haben sich auf die Hyperaktivierung von regenerationsbedingten Transkriptionsfaktoren in ZNS-Neuronen gestützt. Zum Beispiel stimulierte die Überexpression des Stat3-Transkriptionsfaktors die axonale Regeneration im Sehnerv 20 . Trotzdem ersetzen sowohl die Biomolekülabgabe als auch die Überexpression von Transkriptionsfaktoren die verlorenen neuronalen Populationen nicht. Zellbasierte Strategien konzentrierten sich vor allem auf die Verpflanzung von neuralen Stammzellen (NSCs) in das ZNS, wobei sie ihre Fähigkeit nutzen, ZNS-Neuronen zu ersetzen, trophische Faktoren freizugeben,Und unterstützen die Neurogeneseversuche, die nach Verletzung auftreten 17 . Trotzdem gibt es immer noch dringende Herausforderungen, die diesen Ansatz behindern, einschließlich der behinderten Fähigkeit, transplantierte neuronale Zellen zu überleben, mit dem Wirt zu integrieren und räumlich auf den verletzten Bereich 6 , 14 , 17 , 21 zu beschränken. Darüber hinaus ist die Zelllieferung allein nicht in der Lage, die Cytoarchitektur von beschädigten oder verlorenen axonalen Wegen wiederherzustellen. Ein alternativer Ansatz, der die Probleme der Zelle und der Arzneimittel- / Chemikalienabgabestrategien anspricht, kombiniert diese Ansätze mit dem Einsatz von Biomaterialien 14 , 22 , 23 . Biomaterialien wie Hydrogele sind in der Lage, die biochemischen und physikalischen Eigenschaften der extrazellulären Matrix (ECM) zu emulieren, wobei sie in der Zellabgabe undD Retention innerhalb des verletzten Bereichs und liefert Wachstumsfaktoren und andere bioaktive Moleküle mit kontrollierter Freisetzung 22 . Die attraktiven Merkmale dieser biomaterialbasierten Strategien haben zu einer Nachweis der in vivo axonalen Regeneration nach der Transplantation von Gerüsten in den Läsionsbereich 24 , 25 , 26 , 27 , 28 , 29 , 30 geführt . Allerdings ersetzen azelluläre Biomaterial-Strategien nicht verlorene neuronale Populationen; Wenn sie als Lieferfahrzeuge für neuronale, gliale oder neuronale Vorläuferzellen verwendet werden, sind Biomaterialien nicht in der Lage, Fern-Axonal-Netzwerke zu rekonstituieren. Die Herausforderung, einen Ansatz zu entwickeln, der sowohl die axonale Wegdegeneration als auch den neuronalen Verlust, der mit der ZNS-Verletzung und der Krankheit verbunden ist, bekämpft, bleibt noch <Sup class = "xref"> 31.
Unsere Forschungsgruppe berichtete bisher über die Entwicklung von implantierbaren mikrogewebetechnischen neuronalen Netzwerken (Mikro-TENNs), die eine Art von "lebendem Gerüst" sind, bestehend aus neuronalen Zellkörpern, die auf ein oder beide Enden einer Agarose-Hydrogel-ECM-Mikrosäule beschränkt sind Mit ausgerichteten axonalen Traktaten, die sich im gesamten Inneren dieser dreidimensionalen (3D) Umhüllung 1 , 10 , 31 , 32 erstrecken. Einer der Hauptunterschiede zwischen dieser Technik und früheren Ansätzen besteht darin, dass die Cytoarchitektur von Mikro-TENNs vollständig in vitro erzeugt und danach nach 33 , 34 , 35 , 36 , 37 , 38 , <transplantiert wirdSup class = "xref"> 39 , 40 , 41 . In-vitro- Fertigung bietet eine ausgedehnte räumliche und zeitliche Kontrolle von zellulärem Phänotyp und Orientierung, mechanisch-physikalischen Eigenschaften, biochemischen Cues und exogenen Faktoren, die die Integration dieser Gerüste mit dem Wirt nach der Implantation 41 , 42 zugute kommen . Mikro-TENNs sind anatomisch inspiriert, weil sie die Hirnneuroanatomie emulieren und axonale Traktate zeigen, die denen ähnlich sind, die verschiedene funktionale Bereiche des Gehirns überbrücken (Abbildung 1A ) 1 . Daher kann diese Strategie in der Lage sein, die verlorenen weißen Materie Traktate und Neuronen nach der Implantation in eine läsionierte Region physisch zu ersetzen. Diese Technik wird auch von Entwicklungsmechanismen inspiriert, in denen "natürliche lebende Gerüste", die durch radiale Gliazellen und wegweisende Axone gebildet werden, als Wegweiser für Zelle dienenMigration aus der subventrikulären Zone und axonale Auswüchse bzw. 43 . Diese Mechanismen werden in den ausgerichteten axonalen Traktaten von Mikro-TENNs rekapituliert, die lebende Wege für die neuronale Zellmigration und die axonale Regeneration durch axonvermitteltes axonales Auswachsen darstellen können (Abbildung 1C ) 43 . Darüber hinaus nutzt diese Strategie die synaptische Integration zwischen den Mikro-TENN-Neuronen und nativen Schaltkreisen und bildet neue Relais, die zur funktionellen Wiederherstellung beitragen können (Abbildung 1B ) 43 . Die Fähigkeit zur Synapsenbildung kann auch diesem Ansatz die Möglichkeit geben, das ZNS zu modulieren und auf das Gewebe nach Netzwerkrückmeldung zu reagieren. Zum Beispiel können optogenetisch aktive Neuronen in den lebenden Gerüsten stimuliert werden, um Host-Neuronen durch synaptische Wechselwirkungen zu modulieren (Abbildung 1D ).
Darüber hinaus ist die Biomaterial-basierte RohrkonstruktionDie Vermeidung von Mikro-TENNs bietet eine adäquate Umgebung für die Zelladhäsion, das Wachstum, die Neuritenverlängerung und die Signalisierung, während die Miniaturabmessungen der Konstrukte potentiell eine minimal invasive Implantation ermöglichen und eine teilweise sequestrierte Mikroumgebung für eine allmähliche Integration in das Gehirn bieten. In der Tat haben die jüngsten Veröffentlichungen das Potenzial von Mikro-TENNs nachgewiesen, um neuronale Wege nach der Implantation in das Rattenhirn zu imitieren. Nach der stereotaktischen Mikroinjektion haben wir bisher den Nachweis des mikro-TENN-neuronalen Überlebens, die Aufrechterhaltung der axonalen Traktarchitektur und die Neuritenerweiterung in den Wirtskortex mindestens 1 Monat in vivo 10 , 31 gemeldet. Darüber hinaus lieferte die Markierung mit Synapsin histologische Hinweise auf die synaptische Integration mit dem nativen Gewebe 10 , 31 . Insgesamt können Mikro-TENNs eindeutig geeignet sein, um beschädigt zu rekonstruieren und zu modulierenZNS durch Ersetzen verlorener Neuronen, synaptische Integration mit Host-Schaltungen, Wiederherstellung der verlorenen axonalen Cytoarchitektur und in bestimmten Fällen die Bereitstellung von regenerierenden Axonen mit den entsprechenden Pfadfindungs-Cues.
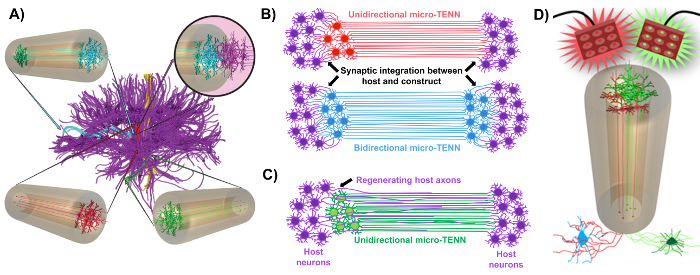
Abbildung 1: Grundsätze und Inspirationen hinter der Entwicklung von mikrogewebetechnischen Neuronennetzen (Mikro-TENNs). ( A ) Micro-TENNs imitieren die Cytoarchitektur des Gehirnverbundes (violett), in der funktionell unterschiedliche Bereiche durch lange, ausgerichtete Axonaltrakte in einer unidirektionalen (rot, grün) oder bidirektionalen (blauen) Weise verbunden sind. Beispielsweise könnten Mikro-TENNs verlorene Verbindungen in kortikothalamischen und nigrostriatalen Bahnen oder im perforanten Weg von der entorhinalen Kortex zum Hippocampus (angepasst von Struzyna et al. , 2015) rekonstituieren. ( B ) Diagramm einer UnidirektionaL und bidirektionale Mikro-TENN (rot und blau) synaptisch mit der Host-Schaltkreise (lila) integriert, um als funktionales Relais zwischen beiden Enden einer Läsion zu dienen. ( C ) Schematische Darstellung der axonalen Traktate eines unidirektionalen Mikro-TENN (grün), die als Leitfaden für die axon-erleichterte Regeneration von Wirts-Axonen (violett) zu einem Ziel dienen, mit dem das Mikro-TENN wechselwirkt. ( D ) Konzeptionelle Darstellung der Verwendung von optogenetisch aktiven Mikro-TENNS als Neuromodulatoren unter Ausnutzung der synaptischen Integration mit exzitatorischen oder inhibitorischen Neuronen (unten). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Das aktuelle Manuskript beschreibt die Methodik, die zur Herstellung von Mikro-TENNs unter Verwendung von embryonal abgeleiteten zerebralen kortikalen Neuronen verwendet wird. Bemerkenswerterweise könnten Mikro-TENNs mit anderen Arten von neuralen Zellen hergestellt werden. Für exReichlich, die ersten Berichte über die erfolgreiche Mikro-TENN-Entwicklung vorgestellten Dorsal Wurzelganglion (DRG) Neuronen 32 . Die Hydrogel-Mikrosäulen können erzeugt werden (Abbildung 2A ) durch Zugabe von flüssiger Agarose zu einer maßgeschneiderten, lasergeschnittenen zylindrischen Kanalanordnung oder zu Kapillarrohren, die beide ausgerichtete Akupunkturnadeln enthalten. Die Nadel bildet das Lumen und bestimmt den Innendurchmesser (ID) der Mikrosäule, während die Kapillarröhren-ID und der Durchmesser der Zylinder in der Laserschneidvorrichtung den Außendurchmesser (OD) der Konstrukte diktieren. Die OD und ID können entsprechend der gewünschten Anwendung gewählt werden, indem man unterschiedliche Durchmesser für die Geräte / Kapillarrohre bzw. die Akupunkturnadeln auswählt. Die Länge der Mikrosäulen kann auch variiert werden; Bisher haben wir den Bau von Mikro-TENNs bis zu 20 mm in der Länge 10 gemeldet und betreiben aktiv noch längere Längen. Nach den Agarosegelen und der Akupunktur nEedles werden entfernt, eine ECM-Lösung, die im allgemeinen aus Kollagen Typ I und Laminin besteht, wird dem Lumen der Konstrukte hinzugefügt ( Fig. 2C ). Der ECM-Kern sorgt für ein Gerüst zur Unterstützung der neuronalen Zelladhäsion und des axonalen Auswuchses. Anfänglich wurden primäre Ratten-kortikale Neuronen in den Mikrosäulen unter Verwendung von dissoziierten Zellsuspensionen 10 , 31 , 32 plattiert. Allerdings hat dieser Ansatz in allen Fällen nicht die Ziel-Cytoarchitektur hervorgebracht, die als die neuronalen Zellkörper definiert wurde, die auf die Enden der Mikrosäulen beschränkt waren, wobei das zentrale Lumen aus reinen, ausgerichteten axonalen Traktaten bestand. Seither hat die Verwendung eines erzwungenen neuronalen Aggregationsverfahrens (basierend auf Protokollen von Ungrin et al .) Eine zuverlässigere und konsistentere Herstellung von Mikro-TENNs mit der idealen Struktur ermöglicht (Abbildung 2B ) 44 . Neben der Beschreibung der aktuellenMethodik, wird dieser Artikel zeigen repräsentative Phasenkontrast und konfokale Bilder von Mikro-TENNs, die die Bildung von axonalen Traktaten im Laufe der Zeit, sowie die finalisierte Ziel-Zytoarchitektur zeigen. Dieses Manuskript wird auch auf bemerkenswerte Aspekte des Protokolls und die verbleibenden Herausforderungen und zukünftigen Richtungen der Mikro-TENN-Technologie erweitern.
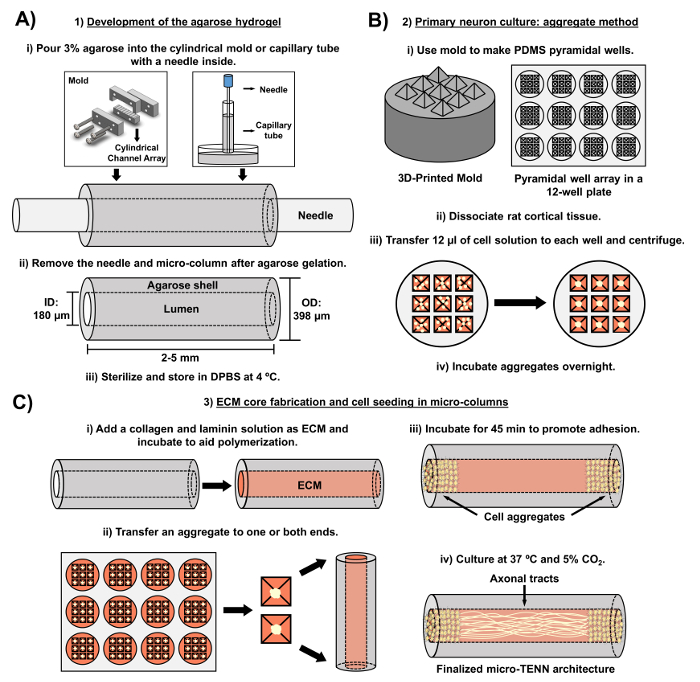
Abbildung 2: Schematische Darstellung des dreistufigen Mikro-TENN-Herstellungsprozesses. ( A ) Entwicklung des Agarose-Hydrogels: (i) Zunächst wird eine kleine Akupunkturnadel ( z. B. 180-350 μm Durchmesser) in die zylindrischen Kanäle einer maßgeschneiderten, lasergeschnittenen Form oder eines Kapillarrohres ( z , Durchmesser von 380-700 μm). Im nächsten Schritt wird flüssige Agarose in DPBS in die zylindrischen Kanäle oder Kapillarrohre eingeführt. (Ii) Nach den Agarosegelen wird die Nadel entfernt undDie Form wird zerlegt, um die hohlen Agarose-Mikrosäulen zu ergeben. (Iii) Diese Konstrukte werden dann sterilisiert und in DPBS gelagert. ( B ) Primäre Neuronenkultur und die Aggregatmethode: (i) Die neuronale Aggregation wird in pyramidenförmigen Mikro-Well-Arrays durchgeführt, die aus 3D-bedruckten Formen gegossen werden, die in die Vertiefungen einer 12-Well-Kulturplatte passen. (Ii) Mikro-TENNs umfassen primäre Rattenneuronen, die von fetalen Gehirnen von Embryon-Tag-18-Ratten dissoziiert sind. Nach der Gewebedissoziation mit Trypsin-EDTA und DNase I wird eine Zelllösung mit einer Dichte von 1,0-2,0 x 10 & sup6; Zelle / ml hergestellt. (Iii) 12 & mgr; l dieser Lösung werden in jede Vertiefung in dem pyramidenförmigen Mikro-Well-Array übertragen. Die Platte, die diese Mikro-Vertiefungen enthält, wird zentrifugiert, um Zellaggregate zu erzeugen. (Iv) Diese werden dann über Nacht vor dem Plattieren in den Mikrosäulen inkubiert. ( C ) ECM-Kernherstellung und Zellseeding: (i) Vor der Zellseedung wurde eine ECM-Lösung mit 1 mg / ml Typ I Kollagen und 1 mg / mlLaminin wird in das Innere der Mikro-TENNs überführt und polymerisiert. (Ii) Abhängig davon, ob unidirektionale oder bidirektionale Mikro-TENNs hergestellt werden, wird ein Aggregat an einem oder beiden Extremen der Mikrosäule platziert. (Iii) Nach einer Inkubationszeit zur Förderung der Adhäsion werden Mikro-TENNs in Petrischalen gezüchtet, die mit einem ergänzten embryonalen neuronalen Basalmedium überflutet sind. (Iv) Nach 3-5 Tagen in Kultur sollte die endgültige Mikro-TENN-Struktur Zelle Aggregate an den Extremen der Mikrosäule zeigen, wobei axonale Traktate ihre Länge überspannen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
ZNS-Verletzungen und Erkrankungen führen typischerweise zu einem Verlust oder einer Dysfunktion der Langstrecken-Axonalwege, die das Gehirn-Verbund umfassen, mit oder ohne begleitende neuronale Degeneration. Dies wird durch die begrenzte Kapazität des ZNS ergänzt, um die Neurogenese und Regeneration zu fördern. Trotz der Verfolgung von Reparaturstrategien wie Wachstumsfaktor, Zelle und Biomateriallieferung als einzelne oder kombinatorische Ansätze scheitern diese Techniken gleichzeitig sowohl für die Degeneration …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die finanzielle Unterstützung wurde von den National Institutes of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) und F31-NS090746 (Katiyar)), der Michael J. Fox Foundation (Therapeutic Pipeline Program # 9998 (Cullen)), Die Penn Medicine Neuroscience Center Pilot Award (Cullen), die National Science Foundation (Graduate Research Fellowships DGE-1321851 (Struzyna und Adewole)), die Abteilung für Veteranen Angelegenheiten (RR & D Merit Review # B1097-I (Cullen)), die American Association Der neurologischen Chirurgen und des Kongresses der neurologischen Chirurgen (2015-2016 Codman-Stipendium in Neurotrauma und Critical Care (Petrov)) und der US Army Medical Research und Materiel Command (# W81XWH-13-207004 (Cullen) und W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

