Le reti neurali ricalcolate anatomicamente tridimensionali dei micro-tessuti per la ricostruzione, la modulazione e la modellazione del sistema nervoso
Summary
Questo manoscritto specifica la realizzazione di reti neurali rivelate micro-tessuto: costruzioni tridimensionali di dimensioni microniche costituite da tratti longitudinali allineati allineati che comprendono la popolazione neuronale aggregata racchiuse in un idrogel tubolare. Questi impalcature viventi possono servire come relè funzionali per ricostruire o modulare la circuiteria neurale o come test-letti biofidelici che imitano la neuroanatomia della materia grigio-bianca.
Abstract
Il recupero funzionale si verifica raramente dopo lesioni o degenerazioni causate da malattie all'interno del sistema nervoso centrale (CNS) a causa dell'ambiente inibitorio e della limitata capacità di neurogenesi. Stiamo sviluppando una strategia per affrontare simultaneamente la perdita di percorso neuronale e axon all'interno del CNS danneggiato. Questo manuale presenta il protocollo di fabbricazione per reti neurali (micro-TENN) progettate da micro-tessuti, costruzioni impiantabili costituiti da neuroni e tratti assonali allineati che attraversano il lumen di matrice extracellulare (ECM) di un cilindro idrogelizzato preformato centinaia di micron di diametro che può estendere centimetri in lunghezza. Gli aggregati neuronali sono delimitati agli estremi dell'incasso tridimensionale e sono allineati da proiezioni assonali. Le micro-TENN sono in una posizione unica come strategia per la ricostruzione del CNS, che emulano aspetti della cytoarchitettura del connettore del cervello e potenzialmente forniscono mezzi per la sostituzione della rete. Il neuGli aggregati ronalmente possono sinaptare con il tessuto ospite per formare nuovi relè funzionali per ripristinare e / o modulare i circuiti mancanti o danneggiati. Questi costrutti possono anche agire come "scaffolds viventi" pro-rigenerativi capaci di sfruttare meccanismi di sviluppo per la migrazione cellulare e la percorrenza axonale, fornendo segnali strutturali e solubili sinergici basati sullo stato di rigenerazione. Le micro-TENN sono fabbricate versando idrogel liquido in uno stampo cilindrico contenente un ago centrato longitudinalmente. Una volta che l'idrogelo ha gellato, l'ago viene rimosso, lasciando una micro-colonna vuota. Una soluzione ECM viene aggiunta al lumen per fornire un ambiente adatto per l'adesione neuronale e l'espansione assonica. I neuroni dissociati vengono aggregati meccanicamente per una precisa semina all'interno di una o entrambe le estremità della micro-colonna. Questa metodologia crea in modo affidabile i costrutti miniaturizzati indipendenti con tratti assonali prolungati che possono ricapitolare le caratteristiche della neuroanatomia cerebrale. Synaptic immGli indicatori di calcio non codificati e codificati geneticamente suggeriscono che le micro-TENN posseggano un'ampia distribuzione sinaptica e un'attività elettrica intrinseca. Di conseguenza, le micro-TENN rappresentano una strategia promettente per la ricostruzione neurochirurgica mirata dei percorsi cerebrali e possono anche essere applicati come modelli biofidelici per studiare i fenomeni neurobiologici in vitro .
Introduction
Una caratteristica comune dei disturbi e delle malattie del sistema nervoso centrale (CNS) come la lesione traumatica del cervello (TBI), lesioni del midollo spinale (SCI), ictus, malattia di Alzheimer e la malattia di Parkinson è la disconnessione dei percorsi assonali e delle cellule neuronali Perdita 1 , 2 , 3 , 4 , 5 , 6 . Ad esempio, quando un colpo ischemico non viene trattato, si stima che gli assoni siano persi a una velocità di 7 miglia di assoni al minuto 5 . Nel caso di TBI, che circa 1,7 milioni di persone sperimentano ogni anno negli Stati Uniti, la degenerazione assonale può continuare a verificarsi anni dopo il trauma, in quanto il pregiudizio iniziale precipita uno stato neurodegenerativo a lungo termine 4 . Aggravatando questi effetti deleteri, il CNS ha una capacità fortemente limitataCittà per la rigenerazione 1 , 7 , 8 , 9 . Dopo la lesione, si sviluppa un ambiente inibitorio caratterizzato da una mancanza di guida diretta a bersagli distanti, nella presenza di inibitori associati alla mielina che ostacolano la crescita del neurite e la formazione di una cicatrice gliale mediante astrociti reattivi 8 , 10 , 11 , 12 . La cicatrice gliale serve come barriera biochimica e fisica alla rigenerazione, con molecole come proteoglicani di condroitina solfato che ostruiscono la crescita dell'assone 8 , 11 . Inoltre, anche se le cellule staminali neurali sono state trovate nel CNS adulto, la produzione di nuovi neuroni è limitata, in quanto una prova consistente di neurogenesi è stata trovata solo nel bulbo olfattivo, l'ippocampoZona subgranulare, zona periventricolare e canale centrale del midollo spinale 13 , 14 . Questi ostacoli impediscono il recupero funzionale dei neuroni perduti e dell'architettura della materia bianca dopo lesioni o malattie, con conseguente effetto spesso alterato e prolungato di queste condizioni.
Nonostante la mancanza di capacità rigenerativa nel CNS adulte, è stato dimostrato che la rigenerazione assonale è possibile se vengono presentati adeguati suggerimenti ambientali ai neuroni ospiti 15 , 16 , 17 , 18 . I ricercatori hanno cercato di trasportare e manipolare fattori di crescita ( ad esempio, fattore di crescita del nervo, fattore di crescita epidermico, fattore di crescita dipendente dagli ialti e fattore neurotrofico 3) e altre molecole di guida per stimolare la plasticità e la rigenerazione dell'assone 14 ,/ Sup> 18 , 19 . Anche se questi studi hanno confermato che gli assoni adulti sono in grado di rispondere ai fattori di crescita, queste strategie sono limitate dalla bassa permeabilità della barriera emato-sangue e dalle specifiche sfumature spaziali e temporali necessarie per promuovere la rigenerazione 14 , 18 e 19 . Altri approcci hanno affidato l'iperattivazione dei fattori di trascrizione correlati alla rigenerazione nei neuroni del CNS. Ad esempio, la sovraespressione del fattore di trascrizione Stat3 stimola la rigenerazione assonale nel nervo ottico 20 . Tuttavia, sia la consegna della biomolecola che la sovraespressione dei fattori di trascrizione non riescono a sostituire le popolazioni neuronali perse. Le strategie cellulari sono state principalmente incentrate sul trapianto di cellule staminali neurali (NSC) nel CNS, sfruttando la loro capacità di sostituire i neuroni CNS, rilasciare fattori trofici,E sostenere i tentativi di neurogenesi che si verificano dopo lesioni 17 . Nonostante ciò, ci sono ancora pressanti sfide che ostacolano questo approccio, compresa la capacità ostacolata delle cellule neurali trapiantate per sopravvivere, integrarsi con l'ospite e rimanere spazialmente limitati all'area ferita 6 , 14 , 17 , 21 . Inoltre, la sola consegna cellulare non è in grado di reintegrare la citoarchitettura di percorsi axonal danneggiati o persi. Un approccio alternativo che affronta i problemi che si trovano ad affrontare le strategie di consegna di cellule e droga / chimica sta combinando questi approcci con l'uso dei biomateriali 14 , 22 , 23 . I biomateriali come gli idrogeli sono in grado di emulare le proprietà biochimiche e fisiche della matrice extracellulare (ECM), aiutando la distribuzione cellulare eD all'interno dell'area ferita e fornendo fattori di crescita e altre molecole bioattive con rilascio controllato 22 . Le caratteristiche interessanti di queste strategie basate su biomateriali hanno portato alla prova della rigenerazione assonica in vivo dopo il trapianto di scaffolds alla zona lesionata 24 , 25 , 26 , 27 , 28 , 29 , 30 . Tuttavia, le strategie biomateriali acellulari non sostituiscono le popolazioni neuronali perse; Quando vengono utilizzati come veicoli di erogazione per cellule precursori neuronali, gliali o neuronali, i biomateriali non sono in grado di ricostituire reti assonali a lunga distanza. La sfida di sviluppare un approccio che affronta sia la degenerazione del percorso assonale che la perdita neuronale associati a lesioni e malattie del CNS rimangono ancora <Sup class = "xref"> 31.
Il nostro gruppo di ricerca ha riportato in precedenza lo sviluppo di reti neurali (micro-TENN), progettate da micropagnetismi impiantabili, che sono un tipo di "scaffold vivente" costituito da corpi cellulari neuronali limitati a una o entrambe le estremità di una micro-colonna idrogel-ECM agarosio , Con tratti assonali allineati in tutto l'interno di questo incasso tridimensionale (3D) 1 , 10 , 31 , 32 . Una delle principali differenze tra questa tecnica e gli approcci precedenti è che la citoarchitettura delle micro-TENNs è stata completamente creata in vitro e viene poi trapiantato dopo 33 , 34 , 35 , 36 , 37 , 38 ,Sup class = "xref"> 39 , 40 , 41 . La fabbricazione in vitro offre un ampio controllo spaziale e temporale del fenotipo cellulare e dell'orientamento, delle proprietà meccaniche / fisiche, dei segnali biochimici e dei fattori esogeni, che beneficiano dell'integrazione di questi scaffolds con l'ospite dopo l'impianto 41 , 42 . Le micro-TENN sono ispirate anatomicamente perché emulano la neuroanatomia del cervello, mostrando tracce assonali simili a quelle che ponte le distinte aree funzionali del cervello ( Figura 1A ) 1 . Pertanto, questa strategia potrebbe essere in grado di sostituire fisicamente i tratti di tessuti bianchi persi e neuroni dopo l'impianto in una regione lesionata. Questa tecnica è ispirata anche da meccanismi di sviluppo in cui "scaffolds viventi naturali" formati da cellule gliali radiali e assoni pionieristici agiscono come guide di percorrenza per celluleMigrazione dalla zona subventricolare e outgrowth axon, rispettivamente 43 . Questi meccanismi sono ricapitolati nei tratti assonali allineati di micro-TENN, che possono presentare percorsi di vita per la migrazione delle cellule neurali e la rigenerazione assonale mediante una crescita assonale mediata dall'assone ( Figura 1C ) 43 . Inoltre, questa strategia sfrutta l'integrazione sinaptica tra i neuroni micro-TENN e il circuito nativo, formando nuovi relè che possono contribuire al recupero funzionale ( Figura 1B ) 43 . La capacità di formazione di sinapsi può anche concedere a questo approccio la capacità di modulare il CNS e di rispondere al tessuto dell'ospite in base ai feedback di rete. Ad esempio, i neuroni ottogeneticamente attivi nei montanti viventi possono essere stimolati per modulare i neuroni dell'ospite attraverso interazioni sinaptiche ( Figura 1D ).
Inoltre, il costruttore tubolare a base biomaterialeLa presenza di micro-TENN offre un ambiente adeguato per l'adesione, la crescita, l'estensione del neurite e la segnalazione delle cellule, mentre le dimensioni in miniatura dei costrutti potenzialmente consentono l'impianto minima invasivo e forniscono un microambiente parzialmente sequestrato per una graduale integrazione nel cervello. Infatti, le pubblicazioni recenti hanno dimostrato il potenziale delle micro-TENN per imitare i percorsi neurali dopo l'impianto nel cervello del topo. A seguito di microinjection stereotassiale, abbiamo precedentemente riportato prove di sopravvivenza neuronale micro-TENN, mantenimento dell'architettura del tratto assonale e estensione del neurite nella corteccia ospite per almeno 1 mese in vivo 10 , 31 . Inoltre, l'etichettatura con la sinapsina ha fornito prove istologiche dell'integrazione sinaptica con il tessuto nativo 10 , 31 . Nel complesso, le micro-TENN possono essere particolarmente adattate per ricostruire e modulare danniCNS sostituendo i neuroni perduti, integrando sinapticamente con il circuito ospite, ripristinando la citoarchitettura assonale persa e, in alcuni casi, fornendo assoni rigeneranti con gli opportuni segnali di percorrenza.
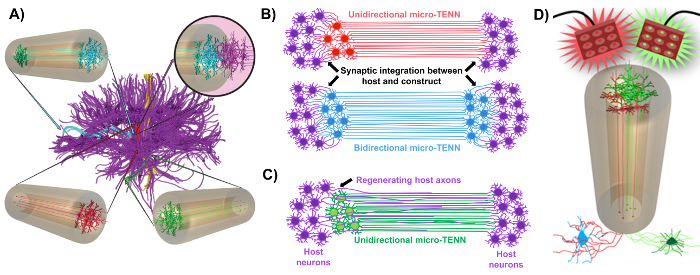
Figura 1: Principi e ispirazione dietro lo sviluppo di reti neurali innovative (micro-TENN). ( A ) Le micro-TENN simulano la citoarchitettura del connettore del cervello (viola), in cui regioni funzionalmente distinte sono collegate da tratti assonali lunghi e allineati in modo unidirezionale (rosso, verde) o bidirezionale (blu). Come esempio, le micro-TENN potrebbero ricostituire le connessioni perse in percorsi corticotalamici e nigrostriatali o nel percorso perforante dalla corteccia entorilina all'ippocampo (adattato da Struzyna et al. , 2015) 1 . ( B ) Diagramma di una unidirezioneL e bidimensionale micro-TENN (rosso e blu) sinapticamente integranti con il circuito ospite (viola) per servire come relè funzionale tra le due estremità di una lesione. ( C ) Schema dei tratti assonali di un micro-TENN unidirezionale (verde) che funge da guida per la rigenerazione degli assoni ospitanti (viola) facilitati dall'assone verso un obiettivo con cui il micro-TENN interagisce. ( D ) Schema concettuale dell'utilizzo di micro-TENNS attivo-otticamente attivi come neuromodulatori, sfruttando l'integrazione sinaptica con neuroni eccitatori o inibitori (in basso). Clicca qui per visualizzare una versione più grande di questa figura.
L'attuale manoscritto illustra la metodologia utilizzata per la realizzazione di micro-TENN utilizzando i neuroni corticali cerebrali embrionati. In particolare, le micro-TENN potrebbero essere fabbricate con altri tipi di cellule neurali. Per esAmpiamente, i primi rapporti di sviluppo micro-TENN di successo hanno caratterizzato i neuroni del ganglio radicale dorsale (DRG) 32 . Le micro-colonne idrogel possono essere generate ( Figura 2A ) aggiungendo agarosio liquido ad una matrice cilindrica a taglio laser su misura oa tubi capillari, entrambi contenenti aghi allineati di agopuntura. L'ago forma il lumen e determina il diametro interno (ID) della micro-colonna, mentre l'ID tubo capillare e il diametro dei cilindri nel dispositivo taglio laser dettano il diametro esterno (OD) dei costrutti. L'OD e l'ID possono essere scelti in base all'applicazione desiderata selezionando diametri differenti per i tubi del dispositivo / capillare e gli aghi di agopuntura rispettivamente. La lunghezza delle micro-colonne può anche essere variata; Ad oggi, abbiamo riportato la costruzione di micro-TENN fino a 20 mm di lunghezza 10 e perseguono attivamente lunghezze ancora più lunghe. Dopo i gel agarosici e l'agopuntura nLe eedle vengono rimosse, una soluzione ECM generalmente costituita da collagene di tipo I e laminina viene aggiunta al lumen dei costrutti ( figura 2C ). Il nucleo ECM fornisce un ponteggio per supportare l'adesione delle cellule neuronali e l'espansione assonica. Inizialmente i neuroni corticali primari del ratto venivano placcati nelle micro-colonne utilizzando sospensioni cellulari dissociate 10 , 31 , 32 . Tuttavia, questo approccio non ha prodotto la citoarchitettura target in tutti i casi, definita come i corpi delle cellule neuronali limitati alle estremità delle micro-colonne, con il lumen centrale costituito da tratti assonali puri allineati. Da allora, l'uso di un metodo di aggregazione neuronale forzata (basato su protocolli adattati da Ungrin e altri ) ha permesso una più affidabile e coerente fabbricazione di micro-TENNs con la struttura ideale ( figura 2B ) 44 . Oltre a descrivere la correnteMetodo, questo articolo mostrerà rappresentativi di fase-fase e immagini confocali di micro-TENN che dimostrano la formazione di tratti assonali nel tempo, così come la citoarchitettura finalizzata. Questo manoscritto si espanderà anche sugli aspetti degni di nota del protocollo e sulle sfide e sulle future direzioni della tecnologia micro-TENN.
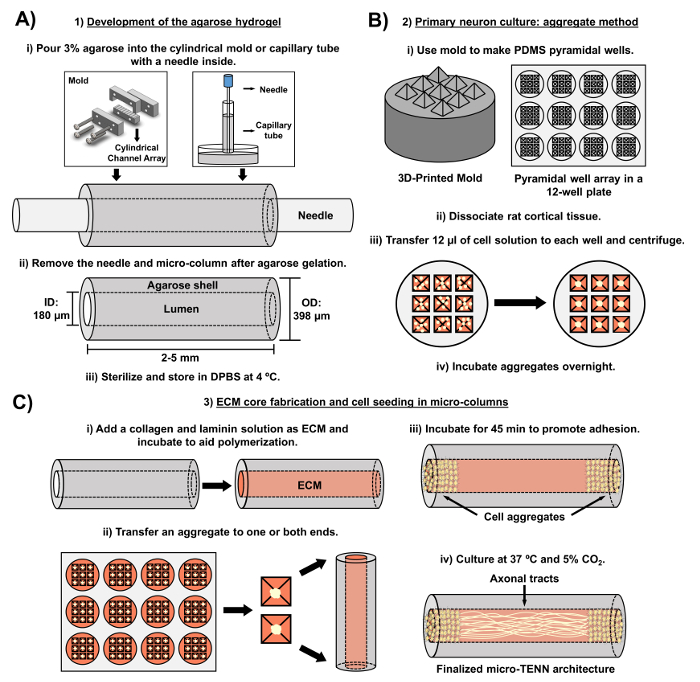
Figura 2: Diagramma schema del processo di fabbricazione micro-TENN a tre stadi. ( A ) Sviluppo dell'idrogel agarosico: (i) Inizialmente, un piccolo aghi di agopuntura ( ad esempio , diametro di 180-350 μm) viene inserito nei canali cilindrici di uno stampo a taglio laser su misura o di un capillare ( ad es. , Diametro 380-700 μm). Nella fase successiva, l'agarosio liquido in DPBS viene introdotto nei canali cilindrici o nei tubi capillari. (Ii) Dopo i gel di agarosio, l 'ago viene rimosso eLo stampo viene smontato per produrre le micro-colonne cave agarose. (Iii) Questi costrutti vengono poi sterilizzati e memorizzati in DPBS. ( B ) La cultura neuronale primaria e il metodo aggregato: (i) L'aggregazione neuronale viene eseguita in matrici di micro-pozzi piramidali, stampate da stampi stampati in 3D, che si inseriscono nei pozzetti di una piastra di coltura a 12 pozzetti. (Ii) Le micro-TENN includono i neuroni primari di ratto dissociati dai cervelli fetali dei ratti embrionali-giorno-18. Dopo la dissociazione tissutale con trypsina-EDTA e DNasi I, viene preparata una soluzione cellulare di densità 1,0-2,0 x 106 cellule / mL. Iii) 12 μL di questa soluzione vengono trasferiti a ciascun pozzetto nella matrice piramidale a micro-pozzetto. La piastra contenente questi micro-pozzetti viene centrifugata per produrre aggregati cellulari. (Iv) Questi vengono quindi incubati durante la notte prima della placcatura nelle micro-colonne. ( C ) Fabbricazione del nucleo ECM e sementi cellulari: (i) Prima della semina cellulare, una soluzione ECM contenente 1 mg / ml di collagene di tipo I e 1 mg / mlIl laminino viene trasferito all'interno delle micro-TENN e permesso di polimerizzare. (Ii) A seconda che si producano micro-TENN unidirezionali o bidirezionali, un aggregato viene posto rispettivamente in uno o entrambi gli estremi della micro-colonna. (Iii) Dopo un periodo di incubazione per promuovere l'adesione, le micro-TENN vengono coltivate in piatti Petri inondati con un mezzo basale neuronale embrionale integrato. (Iv) Dopo 3-5 giorni di coltura, la struttura finale del micro-TENN dovrebbe dimostrare gli aggregati di cellule agli estremi della micro-colonna, con tracce assonali che coprono la sua lunghezza. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
La lesione e la malattia del CNS causano in genere la perdita o la disfunzione dei percorsi assonali a lunga distanza che comprendono il connettore del cervello, con o senza la degenerazione neuronale concomitante. Questo è aggravato dalla limitata capacità del CNS per promuovere la neurogenesi e la rigenerazione. Nonostante il perseguimento di strategie di riparazione come fattori di crescita, cellule e consegna biomateriali come approcci individuali o combinatoriali, queste tecniche non riescono contemporaneamente a…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Il sostegno finanziario è stato fornito dall'Istituto Nazionale di Sanità U01-NS094340 (Cullen), T32-NS043126 (Harris) e F31-NS090746 (Katiyar), la Fondazione Michael J. Fox (Programma Therapeutic Pipeline # 9998 (Cullen) Il Premio pilota del centro di neuropsicologia Penn Medicine (Cullen), la National Science Foundation (DGE-1321851 (Struzyna e Adewole)), il Dipartimento per gli Affari dei Veterani (RR & D Merit Review # B1097-I (Cullen)), Dei Chirurghi Neurologici e del Congresso dei Chirurghi Neurologici (2015-2016 Codman Fellowship in Neurotrauma e Critical Care (Petrov)) e l'US Army Medical Research and Materiel Command (# W81XWH-13-207004 (Cullen) e W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

