신경 시스템 재구성, 변조 및 모델링을 위해 해부학 적으로 영감을받은 3 차원 미세 조직 공학 신경 회로망
Summary
이 원고는 마이크로 조직 공학 신경 네트워크의 제작에 대해 자세히 설명합니다. 3 차원 크기의 마이크론 크기의 구조물은 관 모양의 하이드로 겔에 둘러싸인 집적 된 신경 세포군에 걸친 길쭉한 정렬 축색관으로 구성됩니다. 이러한 살아있는 비계는 신경 회로를 재구성하거나 조절하기위한 기능적 중계 역할을하거나 회색 – 흰색 물질 신경 조직학을 모방 한 생물 여과 테스트 베드 (bifidelic test-bed) 역할을 할 수 있습니다.
Abstract
기능적 회복은 중추 신경계 (CNS) 내의 손상 또는 질병 유발 성 퇴행 후 억제 환경 및 신경 발생에 대한 제한된 용량으로 인해 드물게 발생한다. 우리는 손상된 CNS 내에서 신경 및 축삭 경로 손실을 동시에 처리 할 수있는 전략을 개발 중입니다. 이 원고는 마이크로 조직 공학 신경 네트워크 (micro-TENNs), 뉴런으로 구성된 이식 가능한 구조물 및 센티미터 (centimeters)를 확장 할 수있는 수백 마이크론의 직경을 가진 예비 형성된 하이드로 겔 실린더의 세포 외 매트릭스 (extracellular matrix, ECM) 길이. 신경원 집합체는 3 차원 인장의 극단으로 구분되며 축삭 투영으로 확장됩니다. Micro-TENNs는 CNS 재건을위한 전략으로 두뇌 connectome 세포 구조의 측면을 모방하고 잠재적으로 네트워크 대체 수단을 제공 할 수있는 유일한 자세를 취하고 있습니다. 노이ronal aggregates는 숙주 조직과 시냅스하여 누락되거나 손상된 회로를 복원 및 / 또는 조절하는 새로운 기능적 중계를 형성 할 수있다. 이러한 구조는 또한 세포 재생 및 축삭 경로 찾기를위한 발달 기작을 이용할 수있는 친 재생성 "살아있는 스캐 폴드"로 작용하여 재생 상태를 기반으로 시너지 구조 및 가용성 단서를 제공 할 수 있습니다. Micro-TENN은 액체 하이드로 겔을 종 방향 중심의 바늘이 들어있는 원통형 틀에 주입하여 제조됩니다. 일단 하이드로 겔이 겔화되면 바늘이 제거되어 중공 형 마이크로 컬럼이 남습니다. 루멘에 ECM 솔루션을 추가하여 신경 부착 및 축색 파 성장에 적합한 환경을 제공합니다. 해리 된 뉴런은 미세 기둥의 한쪽 또는 양쪽 끝 부분에 정확한 파종을 위해 기계적으로 응집됩니다. 이 방법론은 장기적으로 돌출 된 축삭 모양의 좁은 구조물을 안정적으로 생산하여 뇌 신경 조직의 특징을 재현 할 수 있습니다. 시냅스 렘unlabelling 및 유 전적으로 코딩 된 칼슘 지시약은 마이크로 TENN이 광범위한 시냅스 분포와 본질적인 전기적 활동을 가지고 있음을 암시합니다. 결과적으로 micro-TENN은 뇌 경로의 신경 외과 재 구축을위한 유망한 전략이며 , 생체 내에서 신경 생리 현상을 연구하기위한 biofidelic 모델로도 적용될 수 있습니다.
Introduction
외상성 뇌 손상 (TBI), 척수 손상 (SCI), 뇌졸중, 알츠하이머 병 및 파킨슨 병과 같은 중추 신경계 (CNS)의 장애 및 질병의 일반적인 특징은 축삭 경로 및 신경 세포의 단절이다 손실 1 , 2 , 3 , 4 , 5 , 6 . 예를 들어, 허혈성 뇌졸중이 치료되지 않으면 축삭이 분당 7 마일의 속도로 손실된다는 것이 추정됩니다. 미국에서만 약 170 만 명의 사람들이 매년 경험하는 TBI의 경우, 초기 손상이 장기간 신경 퇴행성 상태를 유발하기 때문에 축삭 변성이 외상 후 수년 후에도 계속 발생할 수 있습니다 4 . 이러한 유해한 영향을 악화시키는 중추 신경계는 심각한 카파중생을위한 도시 1 , 7 , 8 , 9 . 손상 후, 먼 표적에 대한 유도 지침의 부족, 신경 돌기 성장을 방해하는 미엘린 – 관련 억제제의 존재 및 반응성 성상 교세포 8 , 10 , 11 , 12 에 의한 신경 교뇌 흉터의 형성을 특징으로하는 억제 환경이 발병한다. glial 흉터는 chondroitin sulfate proteoglycans와 같은 분자가 축삭 돌기를 방해하는 생화학 적 및 물리적 장벽으로 작용합니다 8 , 11 . 또한 신경 줄기 세포가 성인 CNS에서 발견 되더라도 신경 발생의 일관된 증거가 후각 구, 해마에서만 발견되어 새로운 신경 세포의 생성이 제한적이다입방 영역, 뇌실 주위 및 척수의 중심 도관 13 , 14 . 이러한 장애물은 상해 또는 질병에 따른 손실 된 뉴런 및 백질 구조의 기능적 회복을 방해하여 종종 이러한 조건의 삶을 변화시키고 연장 된 결과를 초래합니다.
성인 CNS의 재생 능력이 부족 함에도 불구하고 적절한 환경 신호가 호스트 뉴런 15 , 16 , 17 , 18에 제공 되면 축삭 재생이 가능하다는 것이 입증되었습니다. 연구자들은 성장 인자 ( 예 : 신경 성장 인자, 표피 성장 인자, glial 의존 성장 인자 및 신경 영양 인자 3) 및 가소성 및 축색 재생을 자극하는 다른 유도 분자를 전달 및 조작하려고 시도했다 14 ,18 , 19 . 비록 이러한 연구가 성체 축삭 돌기가 성장 인자에 반응 할 수 있다는 것을 확인했지만, 이러한 전략은 혈액 뇌 장벽의 낮은 침투력과 재생을 촉진시키는 데 필요한 특정 공간적, 시간적 변화에 의해 제한된다 14 , 18 , 19 . 다른 접근법은 중추 신경계 뉴런에서 재생 관련 전사 인자의과 활성화에 의존해왔다. 예를 들어, Stat3 전사 인자의 과발현은 시신경에서 축삭 재생을 자극했다. 그럼에도 불구하고, 전사 인자의 생체 분자 전달 및 과발현은 손실 된 연결 집단을 대체하지 못한다. 세포 기반 전략은 주로 신경 줄기 세포 (NSC)를 중추 신경계에 이식하는 것에 중점을두고 있으며, CNS 뉴런을 대체 할 수있는 능력을 활용하고 영양 계수를 방출하며,부상 후 발생하는 신경 발생에 대한 시도를지지한다. 그럼에도 불구하고 이식 된 신경 세포가 생존하고 숙주와 통합되며 상처 부위 6 , 14 , 17 , 21에 공간적으로 제한된 채로 남아있는 방해받는 능력을 포함하여이 접근법을 방해하는 도전 과제가 여전히 남아 있습니다. 또한, 세포 전달만으로 손상되거나 손상된 축삭 경로의 세포 구조를 복원 할 수 없다. 세포 및 약물 / 화학 물질 전달 전략이 직면 한 문제를 해결할 수있는 대체 방법은 이러한 접근법을 생체 물질 14 , 22 , 23 의 사용과 결합하는 것입니다. 하이드로 겔과 같은 생체 재료는 세포 외 매트릭스 (ECM)의 생화학 적 및 물리적 특성을 에뮬레이션 할 수 있으며, 세포 전달을 돕습니다.손상 부위 내에서의 유지, 방출 조절이 가능한 성장 인자 및 기타 생체 활성 물질 전달 22 . 이러한 생체 재료 기반 전략의 매력적인 특성은 발병 지역 24 , 25 , 26 , 27 , 28 , 29 , 30 에 비계를 이식 한 후 생체 내 축삭 재생의 증거를 가져 왔습니다. 그러나, 무 세포 생체 재료 전략은 잃어버린 연결 인구를 대체하지 않는다; 신경 세포, 신경 교세포 또는 신경 전구체 세포의 전달 비히클로 사용될 때, 생체 재료는 장거리 축색 망을 재구성 할 수 없다. CNS 손상 및 질병과 관련된 축삭 경로의 퇴행 및 신경 세포 손실 모두를 다루는 접근법을 개발하는 과제는 여전히 <sup class = "xref"> 31.
우리 연구 그룹은 이전에 아가로 오스 하이드로 겔 -ECM 마이크로 칼럼의 한쪽 또는 양쪽 끝으로 제한되는 신경 세포 몸체로 구성된 "살아있는 비계 (scaffold)"형태의 이식 가능한 미세 조직 공학 신경 네트워크 (마이크로 TENN)의 개발을보고했다 이 3 차원 (3D) 수용체 1 , 10 , 31 , 32 의 내부 전체에 걸쳐 정렬 된 축색 영역이있다. 이 기법과 이전의 접근법의 가장 큰 차이점 중 하나는 micro-TENNs 의 세포 구조 가 in vitro에서 완전히 생성 되어 이후 33 , 34 , 35 , 36 , 37 , 38 ,sup class = "xref"> 39 , 40 , 41 . In vitro 제작은 세포 표현형 및 배향, 기계적 / 물리적 특성, 생화학 적 신호 및 외인성 인자에 대한 광범위한 공간 및 시간 제어 기능을 제공하여 임플란트 후 이러한 인공 지지체를 숙주와 통합하는 데 효과적입니다. Micro-TENN은 해부학 적으로 영감을받습니다. 뇌의 신경 기능을 모방하기 때문에 뇌의 다른 기능 영역을 연결하는 것과 유사한 축삭 영역을 보이기 때문입니다 ( 그림 1A ) 1 . 따라서이 전략은 병변 부위에 이식 한 후 잃어버린 백질 물질과 뉴런을 물리적으로 대체 할 수 있습니다. 이 기술은 또한 방사상의 glial 세포와 개척 축삭에 의해 형성된 "natural living scaffolds"가 세포의 길 찾기 가이드 역할을하는 발달 기작으로부터 영감을 얻습니다subventricular zone과 axonal outgrowth에서의 이동 43 . 이러한 메커니즘은 신경 세포 이동 및 축삭 – 중재 축삭 돌기 ( 그림 1C ) 43에 의한 축삭 재생을위한 살아있는 경로를 제시 할 수있는 마이크로 TENNs의 정렬 axonal 영역에서 recapitulated 있습니다. 또한이 전략은 마이크로 TENN 뉴런과 기본 회로 사이의 시냅스 통합을 활용하여 기능적 복구 ( 그림 1B ) 43 에 기여할 수있는 새로운 릴레이를 형성합니다. 시냅스 형성 용량은 또한이 접근법에 네트워크 피드백에 따라 CNS를 조절하고 숙주 조직에 반응하는 능력을 부여 할 수있다. 예를 들어, 살아있는 발판의 optogenetically 활성 뉴런은 시냅스 상호 작용을 통해 호스트 뉴런을 변조 자극 수 있습니다 ( 그림 1D ).
또한, 생체 재료 기반 관상 면상 구마이크로 TENN의 작용은 세포 부착, 성장, 신경 돌기 확장 및 신호 전달을위한 적절한 환경을 제공하는 반면, 구조물의 미니어처 차원은 잠재적으로 최소 침습성 이식을 허용하고 부분적으로 격리 된 미세 환경을 제공하여 뇌에 점진적으로 통합시킵니다. 사실, 최근의 연구 결과는 쥐의 뇌에 이식 된 이후에 신경 경로를 모방 할 수있는 마이크로 TENN의 잠재력을 보여주었습니다. stereotaxic microinjection 후, 우리는 이전에 마이크로 TENN의 연결의 생존, axonal tract 건축의 유지 및 생체 내 에서 적어도 1 개월까지의 숙주 피질로의 신경 돌기 연장을보고했다. 또한, synapsin으로 라벨링은 원시 조직과의 시냅스 통합의 조직 학적 증거를 제공했다. 전반적으로 마이크로 TENN은 손상된 부분을 재구성하고 변조하는 데 적합 할 수 있습니다CNS는 잃어버린 뉴런을 교체하고, 숙주 회로와 시냅스 적으로 통합하고, 축삭 세포 구조를 잃어버린 채로 복원하며, 경우에 따라 축삭 재생 축삭에 적절한 길 찾기 신호를 제공함으로써 가능합니다.
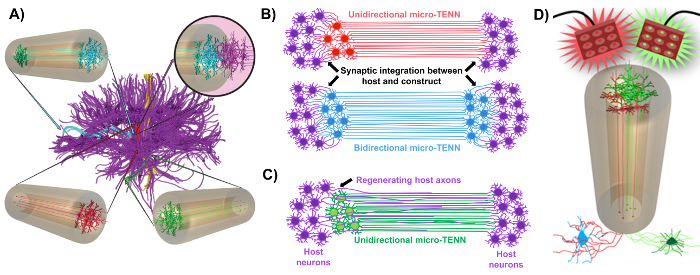
그림 1 : 마이크로 조직 공학 신경 네트워크 (마이크로 TENN) 개발의 원리와 영감 ( A ) Micro-TENN은 기능적으로 구별되는 영역이 단방향 (적색, 녹색) 또는 양방향 (파란색) 방식으로 길고 정렬 된 축색 영역에 의해 연결되는 brain connectome (자주색)의 세포 구조를 모방합니다. 예를 들어, micro-TENNs는 대뇌 피 질 및 흑질 선 경로에서, 또는 entorhinal cortex에서 해마에 이르는 경로에서 분실 된 연결을 재구성 할 수있다 (Struzyna et al. , 2015). ( B ) 단방향의 다이어그램l 및 양방향 micro-TENN (각각 빨간색과 파란색)을 사용하여 병변의 양쪽 끝 사이의 기능 중계 역할을하는 호스트 회로 (자주색)와 통합됩니다. ( C ) micro-TENN이 상호 작용하는 표적을 향한 축색 돌기 (보라색)의 축삭 촉진 재생을위한 가이드 역할을하는 단 향성 마이크로 TENN (녹색)의 축삭 덩어리의 개략도. ( D ) 흥분성 또는 억제 성 뉴런과의 시냅스 통합을 이용하여 신경 조절기로서의 광학 유전 학적으로 활성 인 마이크로 TENNS의 사용에 대한 개념도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
현재의 원고는 배아 적으로 추출 된 대뇌 피질 뉴런을 사용하여 마이크로 TENN을 제조하는 데 사용 된 방법론을 상세히 설명합니다. 주목할 만하게, micro-TENNs는 다른 종류의 신경 세포로 만들어 질 수있다. 예를 들어충분한, 마이크로 TENN 개발 성공의 초기 보고서는 지느러미 뿌리 신경절 (DRG) 뉴런을 특징으로합니다 32 . 하이드로 겔 미세 기둥은 주문 제작 된 레이저 컷 원통형 채널 어레이 또는 모세 혈관 튜브에 액체 아가로 오스를 추가하여 생성 할 수 있습니다 ( 그림 2A ). 바늘은 내강을 형성하고 미세 기둥의 내경 (ID)을 결정하는 반면 모세관 ID 및 레이저 절단 장치의 기둥 직경은 구조체의 외경 (OD)을 결정합니다. OD 및 ID는 장치 / 모세관 및 침침 바늘에 각각 다른 직경을 선택하여 원하는 용도에 따라 선택할 수 있습니다. 미세 기둥의 길이 또한 다양 할 수 있습니다. 지금까지 우리는 길이가 20mm 인 마이크로 TENN의 건설을보고했으며, 더 긴 길이를 적극적으로 추구하고 있습니다. 아가로 오스 겔과 침술 후Eedles를 제거하면 일반적으로 I 형 콜라겐과 라미닌으로 구성된 ECM 용액을 구조물의 루멘에 첨가합니다 ( 그림 2C ). ECM 코어는 신경 세포 접착 및 축색 돌기를지지하기위한 지지체를 제공한다. 초기에, 일차 쥐 대뇌 피질 뉴런은 해리 된 세포 현탁액 10 , 31 , 32 를 사용하여 마이크로 칼럼에 도금되었다. 그러나,이 접근법은 모든 경우에 표적 세포 구조를 생성하지 않았는데, 이는 뉴 칼럼의 말단에 한정된 신경 세포 몸체로 정의되었고, 중심 루멘은 순수한 정렬 된 축삭 영역으로 구성되었다. 그 이후 강제적 인 신경 집계 방법 (Ungrin et al .의 프로토콜을 기반으로 함)을 사용하여 이상적인 구조 ( 그림 2B )로 마이크로 TENN을보다 안정적이고 일관되게 제작할 수있었습니다. 전류를 설명하는 것 외에도방법론에서,이 기사는 시간이 지남에 따라 axonal tracts의 형성을 증명하는 micro-TENN의 대표적인 위상 – 대조 및 공 촛점 이미지뿐만 아니라 최종 표적 세포 구조를 보여줄 것이다. 이 원고는 프로토콜의 중요한 측면과 마이크로 TENN 기술의 향후 과제 및 향후 방향으로 확장 될 것입니다.
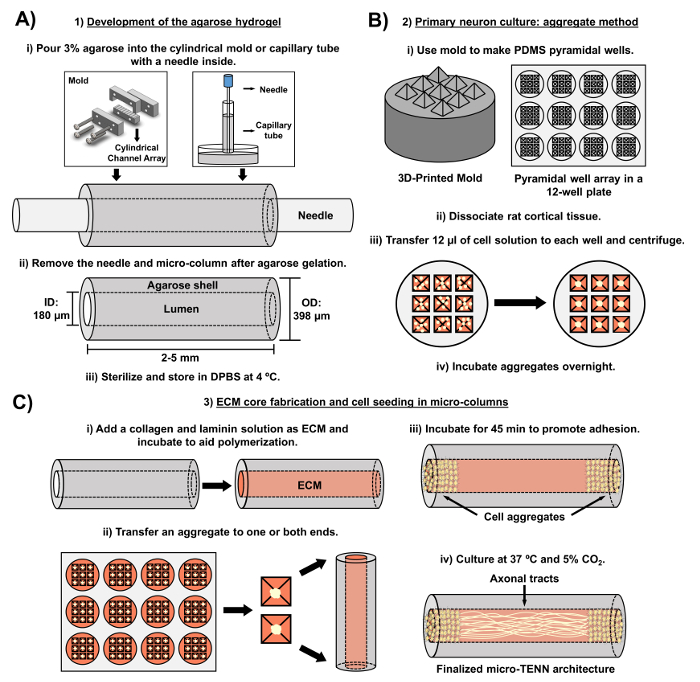
그림 2 : 3 단계 마이크로 TENN 제조 공정의 개략도. ( A ) 아가로 오스 하이드로 겔의 개발 : (i) 처음에는 직경이 180-350 μm 인 작은 침침이 맞춤형 레이저 컷 몰드 또는 모세관 튜브의 원통형 채널에 삽입된다. , 직경 380-700 μm). 다음 단계에서, DPBS의 액상 아가로 오스가 원통형 채널 또는 모세관에 도입된다. (ii) 아가 로스 젤 후, 바늘을 제거하고주형을 분해하여 중공 아가 로스 미세 기둥을 수득한다. (iii) 이들 구조체는 DPBS에 살균되고 저장된다. ( B ) 일차 뉴런 문화와 집계 방법 : (1) 뉴런 집합은 12 잘 배양 접시의 우물에 맞는 3D 인쇄 금형에서 캐스팅 피라미드 형 마이크로 우물 어레이에서 수행됩니다. (ii) Micro-TENN은 배아 일 -18 쥐의 태아 두뇌에서 해리 된 일차 쥐 뉴런을 포함한다. 트립신 -EDTA 및 DNase I로 조직 해리시킨 후, 1.0-2.0 x 106 세포 / mL의 밀도를 갖는 세포 용액을 제조 하였다. (iii)이 용액 12 μL를 피라미드 마이크로 웰 어레이의 각 웰로 옮긴다. 이러한 마이크로 우물을 포함하는 플레이트를 원심 분리하여 세포 응집체를 생성한다. (iv) 이들을 마이크로 칼럼에서 도금하기 전에 밤새 배양한다. ( C ) ECM 코어 제작 및 세포 파종 : (i) 세포 파종 전에, 1 mg / mL 타입 I 콜라겐 및 1 mg / mL를 함유하는 ECM 용액라미닌은 마이크로 TENN의 내부로 전달되어 중합 될 수있다. (ii) 단방향 또는 양방향 micro-TENN이 제조되는지 여부에 따라, 응집체는 마이크로 컬럼의 한쪽 또는 양쪽 극단에 각각 위치한다. (iii) 접착을 촉진하기위한 배양 기간 후, micro-TENNs를 보충 된 배아 뉴론 기저 배지로 침수시킨 페트리 접시에서 배양한다. (iv) 배양 3 ~ 5 일 후, 최종 마이크로 -TENN 구조는 마이크로 – 칼럼의 극단에서 세포 집합체를 보여야하며, 길이에 걸친 축삭 영역이 있어야한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
CNS 손상 및 질병은 전형적으로 부수적 인 신경 세포 변성의 유무에 관계없이 뇌 결합체를 구성하는 장거리 축삭 경로의 손실 또는 기능 부전을 야기한다. 이것은 신경 발생 및 재생을 촉진하는 CNS의 제한된 용량에 의해 합성됩니다. 성장 인자, 세포 및 생체 물질 전달과 같은 수복 전략을 개별적 또는 조합 적 접근으로 추구 함에도 불구하고 이러한 기술은 신경 세포의 퇴행과 축삭 연결의 손실을 …
Disclosures
The authors have nothing to disclose.
Acknowledgements
재정 지원은 U01-NS094340 (컬린), T32-NS043126 (해리스), F31-NS090746 (카티 야), 마이클 J. 폭스 재단 (치료 파이프 라인 프로그램 # 9998 (컬린) (Cullen), 미국 과학 재단 (대학원 연구 동창 DGE-1321851 (Struzyna and Adewole)), Veterans Affairs (RR & D Merit Review # B1097-I (Cullen)), Penn Medicine 신경 과학 센터 파일럿 상 신경 외과 의사 및 신경 외과 의사 회의 (2015-2016 년 신경 외상 및 중환자 실에서의 코닥 개인 연구 (Petrov)) 및 미 육군 의학 연구 및 물질 명령 (# W81XWH-13-207004 (컬른) 및 W81XWH- 0466 (컬른)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

