Анатомически вдохновленные трехмерные микротамовые инженерные нейронные сети для восстановления, модуляции и моделирования нервной системы
Summary
В этой рукописи подробно описывается изготовление микросердечных нейронных сетей: трехмерные микронные конструкции, состоящие из длинных выровненных аксональных трактов, охватывающих совокупную совокупность нейронов, заключенных в трубчатый гидрогель. Эти живые леса могут служить в качестве функциональных реле для восстановления или модуляции нейронных схем или в виде биофиделических пробирок, имитирующих нейроанатомию серо-белого вещества.
Abstract
Функциональное восстановление редко происходит после травмы или вызванной болезнью дегенерации в центральной нервной системе (ЦНС) из-за тормозной среды и ограниченной способности к нейрогенезу. Мы разрабатываем стратегию одновременного устранения нейронных и аксональных потерь пути в поврежденной ЦНС. В этой рукописи представлен протокол изготовления микроштучных инженерных нейронных сетей (micro-TENNs), имплантируемых конструкций, состоящих из нейронов и выровненных аксональных трактов, охватывающих просвет внеклеточного матрикса (ECM) из предварительно сформированного цилиндра гидрогеля диаметром в сотни микрон, который может увеличиваться в сантиметрах в длину. Нейронные агрегаты разделены на крайности трехмерной оболочки и натянуты на аксонные проекции. Микро-TENN уникально сбалансированы как стратегия реконструкции ЦНС, имитируя аспекты цитоархитектуры мозговых соединений и потенциально обеспечивая средства для замены сети. НейРональные агрегаты могут синаптироваться с тканями хозяина, чтобы сформировать новые функциональные реле для восстановления и / или модуляции отсутствующих или поврежденных схем. Эти конструкции могут также выступать в качестве провосстановительных «живых лесов», способных использовать механизмы развития миграции клеток и аксоновского пути, обеспечивая синергические структурные и разрешимые сигналы на основе состояния регенерации. Микро-TENN изготавливают путем заливки жидкого гидрогеля в цилиндрическую форму, содержащую иглу с продольным центрированием. Как только гидрогель гелеобразно, игла удаляется, оставляя полый микроколонец. К просвету добавляют ECM-раствор для обеспечения среды, подходящей для адгезии нейронов и роста аксонов. Диссоциированные нейроны механически агрегируются для точного посева на одном или обоих концах микроколони. Эта методология надежно создает самодостаточные миниатюрные конструкции с длинно проецирующими аксональными трактами, которые могут повторять признаки нейроанатомии мозга. Synaptic immНеметаллические и генетически закодированные индикаторы кальция свидетельствуют о том, что микро-TENN обладают обширным синаптическим распределением и собственной электрической активностью. Следовательно, микро-TENN представляют собой перспективную стратегию для целенаправленной нейрохирургической реконструкции путей мозга и могут также применяться в качестве биофиделических моделей для изучения нейробиологических явлений in vitro .
Introduction
Общей характеристикой расстройств и заболеваний центральной нервной системы (ЦНС), таких как травматическая травма головного мозга (TBI), травма спинного мозга (SCI), инсульт, болезнь Альцгеймера и болезнь Паркинсона, является разъединение аксональных путей и нейронных клеток Потери 1 , 2 , 3 , 4 , 5 , 6 . Например, когда ишемический инсульт не лечится, считается, что аксоны теряются со скоростью 7 миль аксонов в минуту 5 . В случае TBI, который ежегодно испытывает приблизительно 1,7 миллиона человек в США, аксональная дегенерация может продолжаться и после нескольких лет после травмы, поскольку первоначальная травма ускоряет долгосрочное нейродегенеративное состояние 4 . Усугубляя эти вредные эффекты, ЦНС имеет строго ограниченный capaГород для регенерации 1 , 7 , 8 , 9 . После травмы развивается тормозная среда, которая характеризуется отсутствием направленного руководства к отдаленным мишеням, наличию ингибиторов, связанных с миелином, которые препятствуют росту нейритов и образованию глиального шрама реактивными астроцитами 8 , 10 , 11 , 12 . Глиальный шрам служит биохимическим и физическим барьером для регенерации, причем молекулы, такие как протеогликаны хондроитинсульфата, препятствуют росту аксонов 8 , 11 . Кроме того, несмотря на то, что нейронные стволовые клетки обнаружены во взрослой ЦНС, производство новых нейронов ограничено, поскольку последовательные доказательства нейрогенеза были обнаружены только в обонятельной луковице, гиппокампеСубгранулярная зона, перивентрикулярная область и центральный канал спинного мозга 13 , 14 . Эти препятствия препятствуют функциональному восстановлению потерянных нейронов и архитектуры белого вещества после травмы или заболевания, что приводит к часто меняющимся и продолжительным последствиям этих состояний.
Несмотря на отсутствие регенерационной способности у взрослых ЦНС, было продемонстрировано, что регенерация аксонов возможна, если адекватные экологические сигналы представлены в принимающих нейронах 15 , 16 , 17 , 18 . Исследователи пытались доставить и манипулировать факторами роста ( например, фактором роста нервов, эпидермальным фактором роста, глиально-зависимым фактором роста и нейротрофическим фактором-3) и другими молекулами наведения для стимулирования пластичности и регенерации аксонов 14 , </ Sup> 18 , 19 . Несмотря на то, что эти исследования подтвердили, что взрослые аксоны способны реагировать на факторы роста, эти стратегии ограничены низкой проницаемостью гематоэнцефалического барьера и специфическими пространственными и временными градиентами, необходимыми для стимулирования регенерации 14 , 18 , 19 . Другие подходы основывались на гиперактивации факторов транскрипции, связанных с регенерацией, в нейронах ЦНС. Например, сверхэкспрессия фактора транскрипции Stat3 стимулировала регенерацию аксонов в зрительном нерве 20 . Тем не менее, как доставка биомолекулы, так и избыточная экспрессия факторов транскрипции не позволяют заменить потерянные популяции нейронов. Клеточные стратегии в основном сосредоточены на трансплантации нервных стволовых клеток (НСК) в ЦНС, используя их способность заменять нейроны ЦНС, высвобождать трофические факторы,И поддерживать попытки нейрогенеза, которые возникают после травмы 17 . Несмотря на это, все еще существуют насущные проблемы, мешающие этому подходу, в том числе затрудненная способность пересаженных нейронных клеток выжить, интегрироваться с хозяином и оставаться пространственно ограничена поврежденной областью 6 , 14 , 17 , 21 . Кроме того, доставка клеток сама по себе неспособна восстановить цитоархитектуру поврежденных или потерянных аксональных путей. Альтернативный подход, который решает проблемы, стоящие перед стратегиями доставки клеток и наркотиков / химических веществ, сочетает эти подходы с использованием биоматериалов 14 , 22 , 23 . Биоматериалы, такие как гидрогели, способны эмулировать биохимические и физические свойства внеклеточного матрикса (ECM), помогая в доставке клетокD в пределах поврежденной области и доставки факторов роста и других биоактивных молекул с контролируемым высвобождением 22 . Привлекательные характеристики этих стратегий на основе биоматериалов привели к доказательству регенерации аксонов in vivo после трансплантации лесов в пораженные участки 24 , 25 , 26 , 27 , 28 , 29 , 30 . Однако стратегии бесклеточного биоматериала не заменяют потерянные нейронные популяции; При использовании в качестве средств доставки для нейронных, глиальных или нейронных клеток-предшественников, биоматериалы не способны восстанавливать сети аксонов на большие расстояния. Задача разработки подхода, который решает как дегенерацию аксонального пути, так и потерю нейронов, связанную с повреждением ЦНС и заболеванием, по-прежнему остается <Sup class = "xref"> 31.
Наша исследовательская группа ранее сообщала о разработке имплантируемых микро-тканевых нейронных сетей (micro-TENNs), которые являются типом «живого леса», состоящего из тел нейронных клеток, ограниченных одним или обоими концами микроколона с агарозным гидрогелем-ECM , С выровненными аксональными трактами, проходящими по всему внутреннему пространству этого трехмерного (3D) корпуса 1 , 10 , 31 , 32 . Одним из основных различий между этим методом и предыдущими подходами является то, что цитоархитектура микро-TENN создается полностью in vitro и затем трансплантируется 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . Изготовление in vitro предлагает обширный пространственный и временный контроль клеточного фенотипа и ориентации, механические / физические свойства, биохимические сигналы и экзогенные факторы, что выгодно для интеграции этих лесов с хозяином после имплантации 41 , 42 . Micro-TENN анатомически вдохновлены, потому что они эмулируют нейроанатомию мозга, отображая аксональные тракты, похожие на те, которые соединяют различные функциональные области мозга ( рис. 1A ) 1 . Таким образом, эта стратегия может быть в состоянии физически заменить потерянные участки белого вещества и нейроны после имплантации в поврежденную область. Этот метод также вдохновлен механизмами развития, в которых «естественные живые леса», образованные радиальными глиальными клетками и пионерскими аксонами, действуют в качестве направляющих пути для клетокМиграция из субвентрикулярной зоны и рост аксонов соответственно 43 . Эти механизмы рекапилируются в выровненных аксональных участках микро-TENN, которые могут представлять живые пути миграции нейронных клеток и регенерации аксонов с помощью аксоноподобного аксонового выроста ( рис. 1C ) 43 . Кроме того, в этой стратегии используется синаптическая интеграция между нейронами микро-TENN и собственной схемой, образуя новые реле, которые могут способствовать функциональному восстановлению ( рис. 1B ) 43 . Способность к образованию синапсов также может предоставить этому подходу способность модулировать ЦНС и реагировать на ткань хозяина в соответствии с сетевой обратной связью. Например, оптогенетически активные нейроны в живых каркасах могут стимулироваться для модуляции нейронных хозяев через синаптические взаимодействия ( рис. 1D ).
Кроме того, трубчатый контур на основе биоматериаловМикроэнтенозы обеспечивают адекватную среду для клеточной адгезии, роста, расширения нейритов и сигнализации, в то время как миниатюрные размеры конструкций потенциально допускают минимально инвазивную имплантацию и обеспечивают частично секвестрированную микроокружение для постепенной интеграции в мозг. Действительно, недавние публикации продемонстрировали потенциал микро-TENN для имитации нейронных путей после имплантации в мозг крысы. После стереотаксической микроинъекции мы ранее сообщали об обнаружении выживаемости нейронов микро-TENN, поддержании архитектуры аксонального тракта и расширении нейритов в корте головного мозга до, по меньшей мере, 1 месяца in vivo 10 , 31 . Более того, маркировка синапсином давала гистологические свидетельства синаптической интеграции с нативной тканью 10 , 31 . В целом, микро-TENN могут быть уникальными для восстановления и модуляции поврежденныхCNS путем замены потерянных нейронов, синаптической интеграции с хост-схемой, восстановления утраченной аксонной цитоархитектуры и, в некоторых случаях, обеспечения регенерации аксонов соответствующими сигналами пути.
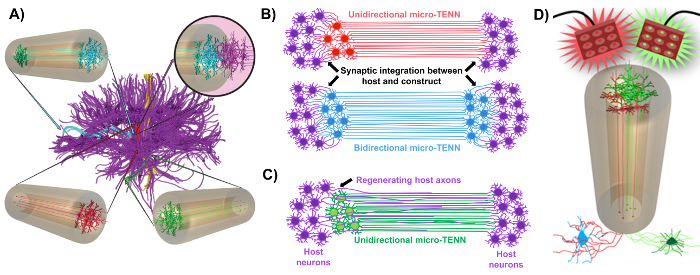
Рисунок 1: Принципы и вдохновение для разработки микросердечных нейронных сетей (микро-TENN). ( A ) Микро-TENN имитируют цитоархитектуру мозгового соединения (фиолетового), в котором функционально различные области связаны длинными выровненными аксональными трактами в однонаправленном (красном, зеленом) или двунаправленном (синем) порядке. Например, микро-TENN могут восстанавливать утраченные связи в кортикоталамическом и нигростриаторном путях или в перфорантном пути от энторинальной коры до гиппокампа (адаптировано из Struzyna et al. , 2015) 1 . ( B ) Диаграмма однонаправленногоL и двунаправленный микро-TENN (красный и синий соответственно), синаптически интегрируемые с главной схемой (фиолетовый), чтобы служить функциональным реле между обоими концами поражения. ( C ) Схема аксональных трактов однонаправленного микро-TENN (зеленая), служащая в качестве ориентира для облегченной аксоном регенерации аксонов хозяина (фиолетового) в направлении мишени, с которой взаимодействует микро-TENN. ( D ) Концептуальная схема использования оптико-активных микро-TENNS в качестве нейромодуляторов, с использованием синаптической интеграции с возбуждающими или тормозящими нейронами (снизу). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В настоящей рукописи подробно изложена методология, используемая для изготовления микро-TENN с использованием эмбрионально полученных церебральных кортикальных нейронов. Примечательно, что микро-TENN могут быть изготовлены с использованием других типов нейронных клеток. ДляДостаточно, исходные сообщения об успешной разработке микро-TENN показали нейроны дорзального корня ганглия (DRG) 32 . Микроэлементы гидрогеля могут быть сгенерированы ( рис. 2А ) путем добавления жидкой агарозы к изготовленной на заказ цилиндрической канальной решетке с лазером или к капиллярным трубкам, содержащим выровненные иглы для иглоукалывания. Игла образует просвет и определяет внутренний диаметр (ID) микроколоны, в то время как идентификатор капиллярной трубки и диаметр цилиндров в устройстве для лазерной резки определяют внешний диаметр (OD) конструкций. OD и ID могут быть выбраны в соответствии с желаемым применением путем выбора различных диаметров для устройства / капиллярных труб и игл для иглоукалывания соответственно. Также можно варьировать длину микроколонок; На сегодняшний день мы сообщили о строительстве микро-ТЭНД длиной до 20 мм в длину 10 и активно преследуем еще более длинные длины. После агарозных гелей и иглоукалывания nЭдельы удаляются, к просвету конструкций добавляется раствор ECM, обычно состоящий из коллагена I типа и ламинина ( фиг. 2C ). Ядро ECM обеспечивает эшафот для поддержки адгезии нейронных клеток и роста аксонов. Первоначально первичные крысиные нейроны крыс были высеяны в микроколонах с использованием диссоциированных клеточных суспензий 10 , 31 , 32 . Однако этот подход не вызывал целевой цитоархитектуры во всех случаях, которая определялась как тела нейронных клеток, ограниченные концами микроколонок, причем центральный просвет состоял из чистых выровненных аксональных трактов. С тех пор использование метода агрегации принудительных нейронов (на основе протоколов, адаптированных из Ungrin и др .) Позволило более надежную и последовательную разработку микро-TENN с идеальной структурой ( рис. 2B ) 44 . В дополнение к описанию текущегоМетодологии, в этой статье будут представлены типичные фазоконтрастные и конфокальные изображения микро-TENN, которые демонстрируют формирование аксональных трактов с течением времени, а также завершенную целевую цитоархитектуру. Эта рукопись также расширит заслуживающие внимания аспекты протокола и остающиеся проблемы и будущие направления технологии микро-TENN.
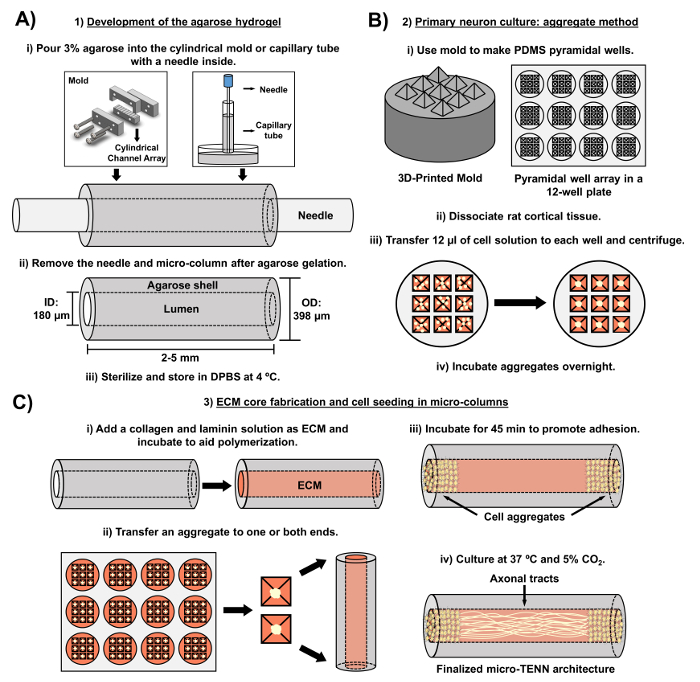
Рисунок 2: Принципиальная схема трехступенчатого процесса изготовления микро-TENN. ( A ) Разработка агарозного гидрогеля: (i) первоначально небольшая иглоукалывающая игла ( например , диаметр 180-350 мкм) вставляется в цилиндрические каналы изготовленной на заказ пресс-формы для лазерной резки или капиллярной трубки ( например, , 380-700 мкм в диаметре). На следующем этапе жидкая агароза в DPBS вводится в цилиндрические каналы или капиллярные трубки. (Ii) После агарозных гелей игла удаляется иПресс-форму разобрали, чтобы получить полые агарозные микроколоны. (Iii) Эти конструкции затем стерилизуют и хранят в DPBS. ( B ) Первичная культура нейронов и агрегированный метод: (i) Агрегирование нейронов выполняется в пирамидальных массивах микроячейки, отлитых из трехмерных печатных форм, которые помещаются в лунки 12-луночного планшета. (Ii) Микро-TENN включают первичные нейроны крыс, диссоциированные от эмбриональных мозгов крыс эмбрионального дня-18. После диссоциации ткани трипсином-EDTA и ДНКазой I готовят клеточный раствор с плотностью 1,0-2,0 × 10 6 клеток / мл. (Iii) 12 мкл этого раствора переносят в каждую лунку в пирамидальной микроячейке. Пластину, содержащую эти микро-лунки, центрифугируют для получения клеточных агрегатов. (Iv) Затем их инкубируют в течение ночи перед нанесением покрытия в микроколонах. ( C ) Изготовление сердечника ECM и клеточного посева: (i) Перед посевом клеток, ECM-раствор, содержащий 1 мг / мл коллагена I типа и 1 мг / млЛаминин переносят внутрь микро-TENN и дают возможность полимеризоваться. (Ii) В зависимости от того, изготавливаются ли однонаправленные или двунаправленные микро-TENN, агрегат помещается в одну или обе крайности микроколона соответственно. (Iii) После периода инкубации для содействия адгезии микро-TENN культивируют в чашках Петри, залитых добавленной эмбриональной нейронной базальной средой. (Iv) Через 3-5 дней в культуре окончательная микро-TENN-структура должна демонстрировать клеточные агрегаты в экстремумах микроколона, с аксональными трактами, охватывающими ее длину. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Повреждение и заболевание ЦНС обычно приводят к потере или дисфункции дальних аксональных путей, которые включают мозговое соединение, с или без сопутствующей нейронной дегенерации. Это усугубляется ограниченной способностью ЦНС способствовать нейрогенезу и регенерации. Несмотря н…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Финансовую поддержку оказали Национальные институты здравоохранения U01-NS094340 (Cullen), T32-NS043126 (Harris) и F31-NS090746 (Katiyar)), Фонд Майкла Дж. Фока (Программа терапевтического трубопровода № 9998 (Каллен)), Пилотная награда Центра медицины в Пенне (Каллен), Национальный научный фонд (Высшие научные стипендии DGE-1321851 (Стружина и Адевола)), Департамент по делам ветеранов (RR & D Merit Review № B1097-I (Каллен)), Американская ассоциация Неврологических хирургов и Конгресса неврологических хирургов (2015-2016 гг. Codman Fellowship of Neurotrauma and Critical Care (Петров)), а также Медицинское исследование и материальное обеспечение армии США (# W81XWH-13-207004 (Cullen) и W81XWH-15-1- 0466 (Каллен)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

