Anatomisch Geïnspireerde Driedimensionale Microweefsel Geanimeerde Neurale Netwerken voor Nervous System Reconstructie, Modulatie en Modellering
Summary
Dit manuscript bevat informatie over de fabricage van micro-tissue-gemanipuleerde neurale netwerken: driedimensionale micron-grootte constructies die bestaan uit lange uitgelijnd axonale tracten die de geaggregeerde neuronale populatie (n) in een buisvormige hydrogel bekleden. Deze levende steigers kunnen dienen als functionele relais om neurale circuits te reconstrueren of te moduleren of als biofidelische testbedden die grijze-witte materie-neuroanatomie nabootsen.
Abstract
Functioneel herstel komt zelden voor als gevolg van letsel of door de ziekte veroorzaakte degeneratie in het centrale zenuwstelsel (CNS) door de remmende omgeving en de beperkte capaciteit voor neurogenese. We ontwikkelen een strategie om tegelijkertijd neuronale en axonale wegverlies in het beschadigde CNS aan te pakken. Dit manuscript presenteert het fabricageprotocol voor microweefselgemanipuleerde neurale netwerken (micro-TENNs), implanteerbare constructen bestaande uit neuronen en uitgelijnd axonale tracten die het extracellulaire matrix (ECM) lumen van een voorgevormde hydrogelcilinder overspannen, honderden micron in diameter die centimeter kunnen verlengen in lengte. Neuronale aggregaten zijn afgebakend aan de extremen van de driedimensionale omhulling en worden gespannen door axonale projecties. Micro-Tenns zijn uniek gepositioneerd als een strategie voor de reconstructie van het CNS, waarbij aspecten van de hersenbindende cytoarchitectuur worden geïmplementeerd en mogelijk middelen voor netwerkvervanging bieden. De neuRonale aggregaten kunnen samenvallen met gastheerweefsel om nieuwe functionele relais te vormen voor het herstellen en / of moduleren van ontbrekende of beschadigde schakelingen. Deze constructen kunnen ook fungeren als pro-regeneratieve "living scaffolds" die ontwikkelingsmechanismen voor celmigratie en axonale pathfinding kunnen exploiteren, die synergistische structurele en oplosbare signalen op basis van de staat van regeneratie verschaffen. Micro-Tenns worden vervaardigd door vloeibare hydrogel te gieten in een cilindrische vorm die een longitudinale centreerde naald bevat. Zodra de hydrogel gelegerd is, wordt de naald verwijderd, waardoor een holle microkolom wordt gelaten. Een ECM oplossing wordt toegevoegd aan het lumen om een omgeving te verschaffen die geschikt is voor neuronale hechting en axonale uitgroei. Gedissocieerde neuronen worden mechanisch geaggregeerd voor precies zaaien in één of beide uiteinden van de microkolom. Deze methodologie produceert betrouwbaar zelfstandige miniatuurconstructen met langwerpige axonale tracten die de kenmerken van hersenneuranatomie kunnen herkapituleren. Synaptische immNiet-etiketterende en genetisch gecodeerde calciumindicatoren suggereren dat micro-TENN's uitgebreide synaptische verdeling en intrinsieke elektrische activiteit bezitten. Bijgevolg vormen micro-TENNEN een veelbelovende strategie voor gerichte neurochirurgische reconstructie van hersenwegen en kunnen ook worden toegepast als biofidelische modellen om neurobiologische verschijnselen in vitro te bestuderen.
Introduction
Een algemeen kenmerk van aandoeningen en ziekten van het centrale zenuwstelsel (CNS), zoals traumatisch hersenletsel (TBI), ruggenmergletsel (SCI), beroerte, de ziekte van Alzheimer en de ziekte van Parkinson, is de ontkoppeling van axonale wegen en neuronale cellen Verlies 1 , 2 , 3 , 4 , 5 , 6 . Bijvoorbeeld, wanneer een ischemische beroerte onbehandeld wordt, wordt geschat dat axonen verloren gaan met een snelheid van 7 mijl axonen per minuut 5 . In het geval van TBI, die ongeveer 1,7 miljoen mensen elk jaar alleen in de VS ervaren, kan axonale degeneratie jaar na trauma blijven optreden, aangezien de aanvankelijke verwonding een langdurige neurodegeneratieve toestand 4 neigt. Versterking van deze schadelijke effecten, het CNS heeft een zeer beperkte capaStad voor regeneratie 1 , 7 , 8 , 9 . Na aanleiding van het letsel ontstaat een remmende omgeving die wordt gekenmerkt door een gebrek aan gerichte begeleiding naar verre doelen, de aanwezigheid van myeline geassocieerde remmers die neuritale uitgroei verhinderen en de vorming van een glialeire door reactieve astrocyten 8 , 10 , 11 , 12 . Het gliaire doet dienst als een biochemische en fysieke barrière voor regeneratie, met moleculen zoals chondroïtinesulfaatproteoglycanen die axongroei 8 , 11 belemmeren. Bovendien, hoewel neurale stamcellen zijn gevonden in het volwassen CNS, is de productie van nieuwe neuronen beperkt, aangezien consistent bewijs van neurogenese alleen is gevonden in de olfactorische bol, de hippocampaleSubgranulaire zone, het periventriculaire gebied en het centrale kanaal van het ruggenmerg 13 , 14 . Deze obstakels verhinderen het functionele herstel van verloren neuronen en witte materie architectuur als gevolg van letsel of ziekte, wat resulteert in de vaak veranderende en langdurige effecten van deze omstandigheden.
Ondanks het gebrek aan regeneratieve capaciteit in het volwassen CNS, is aangetoond dat axonale regeneratie mogelijk is als adequate milieueisen worden voorgesteld aan de gastheer neuronen 15 , 16 , 17 , 18 . Onderzoekers hebben geprobeerd groeifactoren te leveren en te manipuleren ( bijv. De zenuwgroeifactor, de epidermale groeifactor, de glial-afhankelijke groeifactor en de neurotrofische factor-3) en andere begeleidingsmoleculen om de plasticiteit en axonregeneratie te stimuleren 14 , </ Sup> 18 , 19 . Hoewel deze studies hebben bevestigd dat volwassen axonen in staat zijn om op groeifactoren te reageren, worden deze strategieën beperkt door de lage permeabiliteit van de bloed-hersenbarrière en de specifieke ruimtelijke en temporale gradiënten die nodig zijn om regeneratie 14 , 18 , 19 te bevorderen. Andere benaderingen zijn gebaseerd op de hyperactivatie van regeneratie gerelateerde transcriptiefactoren in CNS neuronen. Bijvoorbeeld stimuleerde overexpressie van de stat3 transcriptiefactor axonale regeneratie in de optische zenuw 20 . Desalniettemin slaan zowel de biomoleculeafgifte als de overexpressie van transcriptiefactoren in de plaats van verloren neuronale populaties. Cell-based strategieën hebben vooral betrekking op transplantatie van neurale stamcellen (NSC's) in het CNS, waarbij zij profiteren van hun capaciteit om CNS neuronen te vervangen, trofische factoren te vrijgeven,En ondersteun de pogingen op neurogenese die zich voordoen na verwonding 17 . Ondanks dit zijn er nog steeds uitdagende uitdagingen die deze aanpak verhinderen, inclusief het belemmerde vermogen van getransplanteerde neurale cellen om te overleven, integreren met de gastheer en blijven ruimtelijk beperkt tot het gewond gebied 6 , 14 , 17 , 21 . Daarnaast is de levering van cellen alleen niet in staat om de cytoarchitectuur van beschadigde of verloren axonale wegen te herstellen. Een alternatieve benadering die betrekking heeft op de problemen die cel- en drug / chemische afleverstrategieën voordoen, combineert deze benaderingen met het gebruik van biomaterialen 14 , 22 , 23 . Biomaterialen zoals hydrogelen kunnen de biochemische en fysische eigenschappen van de extracellulaire matrix (ECM) emulerenD retentie binnen het gewond gebied, en het leveren van groeifactoren en andere bioactieve moleculen met gereguleerde afgifte 22 . De aantrekkelijke kenmerken van deze biomaterialen gebaseerde strategieën hebben geleid tot bewijs van in vivo axonale regeneratie na de transplantatie van steigers naar het lesion gebied 24 , 25 , 26 , 27 , 28 , 29 , 30 . Echter, acellulaire biomaterialestrategieën vervangen geen verloren neuronale populaties; Bij gebruik als leveringsvoertuigen voor neuronale, gliale of neuronale precursorcellen, zijn biomaterialen niet in staat om axonale netwerken op lange afstand te reconstrueren. De uitdaging om een aanpak te ontwikkelen die zowel de axonale wegdegeneratie als neuronale verlies in verband met CNS-letsel en ziekte bestrijkt, blijft <Sup class = "xref"> 31.
Onze onderzoeksgroep heeft eerder de ontwikkeling van implanteerbare microweefselgemanipuleerde neurale netwerken (micro-TENN's) gemeld, die een type "levende steiger" zijn die bestaat uit neuronale cellichamen die beperkt zijn tot één of beide uiteinden van een agarose hydrogel-ECM microkolom , Met uitgelijnd axonale tracten die zich uitstrekken over het binnenste van deze driedimensionale (3D) omhulling 1 , 10 , 31 , 32 . Een van de belangrijkste verschillen tussen deze techniek en eerdere benaderingen is dat de cytoarchitectuur van micro-TENNEN volledig in vitro wordt gecreëerd en daarna 33 , 34 , 35 , 36 , 37 , 38 wordt getransplanteerd <Sup class = "xref"> 39 , 40 , 41 . In vitro fabricage biedt uitgebreide ruimtelijke en temporale controle van cellulaire fenotype en oriëntatie, mechanische / fysische eigenschappen, biochemische signalen en exogene factoren, die de integratie van deze steigers bij de gastheer na de implantatie 41 , 42 ten goede komen . Micro-Tenns zijn anatomisch geïnspireerd omdat ze neuroanatomie van de hersenen emuleren, waarbij axonale tracten worden weergegeven die vergelijkbaar zijn met die welke verschillende functionele gebieden van de hersenen gebruiken ( Figuur 1A ) 1 . Daarom kan deze strategie fysieke vervanging van verloren witte materiaalkanalen en neuronen na implantatie in een gewaarschelde regio vervangen. Deze techniek wordt ook geïnspireerd door ontwikkelingsmechanismen waarin "natuurlijke levende stellingen" gevormd door radiale gliale cellen en pioniers axonen fungeren als pathfinding gidsen voor celMigratie uit de subventriculaire zone en axonale uitgroei, respectievelijk 43 . Deze mechanismen worden teruggevonden in de uitgelijste axonale tracten van micro-TENNs, die leefwegen voor neurale celmigratie en axonale regeneratie kunnen voorstellen door axon-gemedieerde axonale uitgroei ( Figuur 1C ) 43 . Bovendien maakt deze strategie gebruik van synaptische integratie tussen de micro-TENN-neuronen en de inheemse schakelingen, waarbij nieuwe relais worden gevormd die kunnen bijdragen tot functioneel herstel ( Figuur 1B ) 43 . De capaciteit voor synapsvorming kan deze aanpak ook de mogelijkheid bieden om het CNS te moduleren en te reageren op gastheerweefsel volgens netwerk feedback. Optogenetisch actieve neuronen in de levende stellingen kunnen bijvoorbeeld gestimuleerd worden om gastheerneuronen te moduleren door middel van synaptische interacties ( Figuur 1D ).
Daarnaast heeft de biomaterial-gebaseerde buisvormige constrUitvoering van micro-TENNs biedt een adequate omgeving voor celadhesie, groei, neurietuitbreiding en signalering, terwijl de miniatuurafmetingen van de constructen mogelijk minimaal invasieve implantatie toestaan en een gedeeltelijk gesekwestreerde microomgeving voor geleidelijke integratie in de hersenen mogelijk maken. Inderdaad hebben recente publicaties het potentieel van micro-TENNEN aangetoond om neurale trajecten na implantatie in de ratbrein te nabootsen. Na stereotaxische microinjectie hebben we eerder bewijs van micro-TENN neuronale overleving, onderhoud van axonale tractarchitectuur en neurietuitbreiding in de gastheercortex tot tenminste 1 maand in vivo 10 , 31 gemeld. Bovendien gaf etikettering met synapsine histologisch bewijs van synaptische integratie met natief weefsel 10 , 31 . In het algemeen kunnen micro-TENNES uniek geschikt zijn om beschadigd te reconstrueren en te modulerenCNS door verloren neuronen te vervangen, synaptisch te integreren met gastheercircuits, herstel van verloren axonale cytoarchitectuur en, in bepaalde gevallen, het regenereren van axonen met de juiste pathfinding cues.
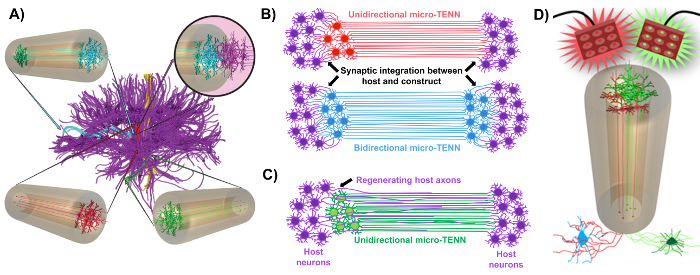
Figuur 1: Principes en inspiratie achter de ontwikkeling van micro-tissue engineered neurale netwerken (micro-TENNs). ( A ) Micro-Tenns nabootsen de cytoarchitectuur van de hersenverbindingen (paars), waarbij functionele afzonderlijke gebieden door middel van lange, uitgelijste axonale tracten in eenrichtingsbewerking (rood, groen) of tweerichtings (blauw) verbonden zijn. Bijvoorbeeld, micro-TENN's kunnen verloren verbindingen in corticothalamus- en nigrostriatale trajecten of in de perforante weg van de entorhinaire cortex tot de hippocampus reconstrueren (aangepast uit Struzyna et al. , 2015) 1 . ( B ) Diagram van een unidirectionaL en bidirectionele micro-TENN (respectievelijk rood en blauw) synaptisch integreren met de gastheercircuit (paars) om als een functioneel relais tussen beide uiteinden van een letsel te dienen. ( C ) Schematisch van de axonale tracten van een unidirectionele micro-TENN (groen), die dienen als een geleiding voor axon-gefaciliteerde regeneratie van host axons (paars) naar een doel waarmee de micro-TENN in wisselwerking is. ( D ) Conceptueel diagram van het gebruik van optogenetisch actieve micro-TENNS als neuromodulators, die profiteren van synaptische integratie met excitatoire of remmende neuronen (bodem). Klik hier om een grotere versie van deze figuur te bekijken.
Het huidige manuscript detaileert de methodologie die wordt gebruikt om micro-TENNEN te vervaardigen met behulp van embryonaal afgeleide cerebrale corticale neuronen. Met name kunnen micro-TENNEN worden vervaardigd met andere soorten neurale cellen. Voor exRuim, de initiële rapporten van succesvolle micro-TENN ontwikkeling gekenmerkt door dorsale root ganglion (DRG) neuronen 32 . De hydrogelmicrokolommen kunnen gegenereerd worden ( Figuur 2A ) door vloeibare agarose aan te voegen aan een op maat gemaakte, lasersnijdende cilindrische kanaalschikking of naar capillaire buizen, die beide uitgelijnd acupunctuurnaalden bevatten. De naald vormt het lumen en bepaalt de binnendiameter (ID) van de microkolom, terwijl de capillaire buis ID en de diameter van de cilinders in het lasergesneden apparaat de buitendiameter (OD) van de constructies dicteren. De OD en ID kunnen volgens de gewenste toepassing worden gekozen door respectievelijk verschillende diameters voor de inrichting / capillaire buizen en de acupunctuurnaalden te selecteren. De lengte van de microkolommen kan ook worden gevarieerd; Tot op heden hebben we de constructie van micro-TENNEN tot 20 mm lang 10 gerapporteerd en actief nog langere lengtes volgen. Na de agarose gels en de acupunctuur nEedles worden verwijderd, een ECM oplossing die in het algemeen bestaat uit type I collageen en laminine wordt toegevoegd aan het lumen van de constructen ( Figuur 2C ). De ECM-kern biedt een steiger ter ondersteuning van neuronale celadhesie en axonale uitgroei. Aanvankelijk werden primaire ratcorticale neuronen geplateerd in de microkolommen met behulp van gedissocieerde cel suspensies 10 , 31 , 32 . Deze aanpak produceerde echter niet in alle gevallen de target cytoarchitectuur, die werd gedefinieerd als de neuronale cellichamen die beperkt waren tot de uiteinden van de microkolommen, waarbij het centrale lumen bestaat uit zuivere uitgelijnd axonale tracten. Sindsdien is het gebruik van een gedwongen neuronale aggregatie methode (gebaseerd op protocols aangepast aan Ungrin et al .) Een betrouwbare en consistente fabricage van micro-TENNEN mogelijk gemaakt met de ideale structuur ( Figuur 2B ) 44 . Naast het beschrijven van de huidigeMethodologie, zal dit artikel representatieve fasecontrast- en confocale beelden van micro-TENNs tonen die de vorming van axonale tracten over de tijd tonen, evenals de gefinaliseerde doelcytoorarchitectuur. Dit manuscript zal ook uitbreiden op opmerkelijke aspecten van het protocol en de resterende uitdagingen en toekomstige aanwijzingen van de micro-TENN-technologie.
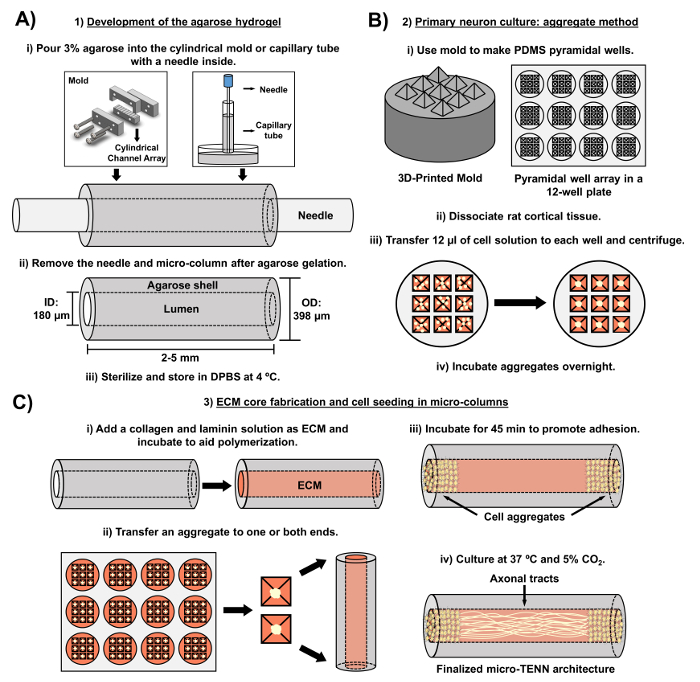
Figuur 2: Schematisch diagram van het driedimensionale micro-TENN fabricageproces. ( A ) Ontwikkeling van de agarosehydrogel: (i) Aanvankelijk wordt een kleine acupunctuurnaald ( bijv . 180-350 μm in diameter) in de cilindrische kanalen van een op maat gemaakte, lasergesneden vorm of een kapillair buis geplaatst ( bijv. , Diameter 380-700 μm). In de volgende stap wordt vloeibare agarose in DPBS geïntroduceerd in de cilindrische kanalen of capillaire buizen. (Ii) Na de agarosegels wordt de naald verwijderd enDe vorm wordt gedemonteerd om de holle agarose microkolommen te geven. (Iii) Deze constructies worden dan gesteriliseerd en opgeslagen in DPBS. ( B ) Primaire neuroncultuur en de aggregaatmethode: (i) Neuronale aggregatie wordt uitgevoerd in pyramidale micro-well arrays, gegoten uit 3D-gedrukte schimmels, die passen in de putjes van een 12-wells kweekplaat. (Ii) Micro-TENNs omvatten primaire ratneuronen die zijn losgelaten van foetale hersenen van embryonale-dag-18 ratten. Na afloop van weefseldissociatie met trypsine-EDTA en DNase I wordt een celoplossing met een dichtheid van 1,0-2,0 x 106 cellen / ml bereid. (Iii) 12 μl van deze oplossing worden overgebracht naar elke put in de pyramidale micro-put-array. De plaat die deze microputjes bevat, wordt gecentrifugeerd om celaggregaten te produceren. (Iv) Deze worden vervolgens overnacht geïncubeerd voorafgaand aan plating in de microkolommen. ( C ) ECM-kernfabrikatie en celzaden: (i) Vóór het zaaien van een cel, een ECM-oplossing die 1 mg / ml type I collageen en 1 mg / ml bevatLaminine wordt overgebracht naar het interieur van de micro-TENNEN en mag polymeriseren. (Ii) Afhankelijk van de vraag of unidirectionele of bidirectionele micro-TENNEN worden vervaardigd, wordt een aggregaat geplaatst op respectievelijk één of beide uitersten van de microkolom. Iii) Na een periode van incubatie om adhesie te bevorderen, worden micro-TENNEN gekweekt in Petri-schalen die zijn overspoeld met aangevulde embryonale neuronale basale media. Iv) Na 3-5 dagen in de cultuur, moet de uiteindelijke micro-TENN-structuur celaggregaten aantonen bij de uitersten van de microkolom, met axonale tracten die zijn lengte overspannen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
CNS letsel en ziekte resulteert typisch in het verlies of de disfunctie van de long-distance axonale pathways die de hersenverbinding omvatten, met of zonder gelijktijdige neuronale degeneratie. Dit wordt gecompenseerd door de beperkte capaciteit van het CNS om neurogenese en regeneratie te bevorderen. Ondanks het streven naar herstelstrategieën zoals groeifactor-, cel- en biomateriaalafgifte als individuele of combinatorische benaderingen, falen deze technieken tegelijkertijd niet alleen de degeneratie van neuronale c…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Financiële steun is verstrekt door de National Institute of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) en F31-NS090746 (Katiyar)), de Michael J. Fox Foundation (Therapeutische Pijpleiding Programma 9998 (Cullen) De Cullen, de National Science Foundation (DN-1321851, Struzyna en Adewole), de afdeling Veteranenzaken (RR & D Merit Review # B1097-I (Cullen)), de American Association Neurologische Chirurgen en Congres van Neurologische Chirurgen (Codman Fellowship in Neurotrauma en Critical Care) (2015-2016) en het Amerikaanse Geneeskunde-onderzoeks- en materiaalkommando (# W81XWH-13-207004 (Cullen) en W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

