Anatomía Inspirada Tridimensional Micro-tejido Ingeniería de Redes Neuronales para la Reconstrucción del Sistema Nervioso, Modulación y Modelado
Summary
Este manuscrito detalla la fabricación de redes neuronales de ingeniería micro-tejidos: construcciones tridimensionales de tamaño micrométrico compuestas por extensos tramos axonales alineados que abarcan la (s) población (es) neuronal (es) agregada (s) encerrada (s) en un hidrogel tubular. Estos andamios vivos pueden servir como relés funcionales para reconstruir o modular circuitos neuronales o como bancos de pruebas biofidelic imitando la neuroanatomía de la sustancia gris-blanca.
Abstract
La recuperación funcional rara vez ocurre después de la lesión o la degeneración inducida por la enfermedad dentro del sistema nervioso central (SNC) debido al entorno inhibitorio y la capacidad limitada para la neurogénesis. Estamos desarrollando una estrategia para abordar simultáneamente la pérdida de la vía neuronal y axonal dentro del SNC dañado. Este manuscrito presenta el protocolo de fabricación de redes neuronales de ingeniería micro-tejidos (micro-TENNs), construcciones implantables que consisten en neuronas y tramos axonales alineados que abarcan la luz de la matriz extracelular (ECM) de un cilindro de hidrogel preformado de centímetros de micrómetros de diámetro que puede extenderse centímetros en longitud. Los agregados neuronales están delimitados a los extremos del recubrimiento tridimensional y están atravesados por proyecciones axonales. Los micro-TENNs se encuentran en una posición única como estrategia para la reconstrucción del SNC, emulando aspectos de la citoarquitectura del conector cerebral y proporcionando potencialmente medios para el reemplazo de la red. El neuLos agregados ronales pueden sinapsar con el tejido huésped para formar nuevos relés funcionales para restaurar y / o modular circuitos perdidos o dañados. Estas construcciones también pueden actuar como andamios vivos pro-regenerativos capaces de explotar mecanismos de desarrollo para la migración celular y la búsqueda axonal, proporcionando pistas estructurales y solubles sinérgicas basadas en el estado de regeneración. Los micro-TENN se fabrican vertiendo el hidrogel líquido en un molde cilíndrico que contiene una aguja centrada longitudinalmente. Una vez que el hidrogel se ha gelificado, la aguja se retira, dejando una micro-columna hueca. Se añade una solución de ECM a la luz para proporcionar un entorno adecuado para la adhesión neuronal y el crecimiento axonal. Las neuronas disociadas se agregan mecánicamente para una siembra precisa dentro de uno o ambos extremos de la micro-columna. Esta metodología produce confiablemente construcciones miniatura autónomas con tramos axonales de proyección larga que pueden recapitular características de la neuroanatomía cerebral. Synaptic immUnolabeling y los indicadores de calcio genéticamente codificados sugieren que los micro-TENNs poseen amplia distribución sináptica y la actividad eléctrica intrínseca. En consecuencia, los micro-TENNs representan una estrategia prometedora para la reconstrucción neuroquirúrgica dirigida de las vías cerebrales y también pueden aplicarse como modelos biofidelicos para estudiar los fenómenos neurobiológicos in vitro .
Introduction
Una característica común de los trastornos y enfermedades del sistema nervioso central (CNS), como lesión cerebral traumática (TBI), lesión de la médula espinal (SCI), accidente cerebrovascular, enfermedad de Alzheimer y enfermedad de Parkinson es la desconexión de las vías axonales y células neuronales Pérdida 1 , 2 , 3 , 4 , 5 , 6 . Por ejemplo, cuando un accidente cerebrovascular isquémico no se trata, se estima que los axones se pierden a una velocidad de 7 millas de axones por minuto [ 5] . En el caso de TBI, que aproximadamente 1,7 millones de personas experimentan cada año sólo en los EE.UU., la degeneración axonal puede seguir ocurriendo años después del trauma, ya que la lesión inicial precipita un estado neurodegenerativo a largo plazo [ 4] . Agravando estos efectos deletéreos, el SNC tiene una capa severamente limitadaCiudad para la regeneración 1 , 7 , 8 , 9 . Después de la lesión, se desarrolla un ambiente inhibitorio que se caracteriza por la falta de orientación dirigida a objetivos distantes, la presencia de inhibidores asociados a mielina que impiden el crecimiento de neuritas y la formación de una cicatriz glial por astrocitos reactivos 8 , 10 , 11 , 12 . La cicatriz gliales sirve como una barrera bioquímica y física para la regeneración, con moléculas como la condroitina sulfato proteoglicanos que obstruyen la proliferación de axones [ 8 , 11] . Además, aunque se han encontrado células madre neurales en el SNC adulto, la producción de nuevas neuronas es limitada, ya que sólo se ha encontrado evidencia consistente de neurogénesis en el bulbo olfatorio, en el hipocampoLa zona subgranular, el área periventricular y el canal central de la médula espinal 13 , 14 . Estos obstáculos impiden la recuperación funcional de las neuronas perdidas y la arquitectura de la sustancia blanca después de una lesión o enfermedad, dando como resultado los efectos a menudo cambiantes y prolongados de estas condiciones.
A pesar de la falta de capacidad regenerativa en el SNC adulto, se ha demostrado que la regeneración axonal es posible si se presentan muestras ambientales adecuadas a las neuronas huésped 15 , 16 , 17 , 18 . Los investigadores han intentado administrar y manipular factores de crecimiento ( por ejemplo, factor de crecimiento nervioso, factor de crecimiento epidérmico, factor de crecimiento glial dependiente y factor neurotrófico 3) y otras moléculas de orientación para estimular la plasticidad y la regeneración del axón 14 ,/ Sup> 18 , 19 . Aunque estos estudios han confirmado que los axones adultos son capaces de responder a factores de crecimiento, estas estrategias están limitadas por la baja permeabilidad de la barrera hematoencefálica y los gradientes espaciales y temporales específicos necesarios para promover la regeneración 14 , 18 , 19 . Otros enfoques se han basado en la hiperactivación de factores de transcripción relacionados con la regeneración en las neuronas del SNC. Por ejemplo, la sobreexpresión del factor de transcripción Stat3 estimuló la regeneración axonal en el nervio óptico 20 . Sin embargo, tanto la entrega de biomoléculas como la sobreexpresión de factores de transcripción no reemplazan a las poblaciones neuronales perdidas. Las estrategias basadas en células se han centrado principalmente en trasplantar células madre neurales (NSC) en el SNC, aprovechando su capacidad para reemplazar las neuronas del SNC, liberar factores tróficos,Y apoyar los intentos de neurogénesis que se producen después de la lesión [ 17] . A pesar de esto, todavía existen retos apremiantes que impiden este enfoque, incluyendo la dificultad de sobrevivir, integrarse con el huésped y mantenerse espacialmente restringido al área lesionada 6 , 14 , 17 , 21 . Además, la administración celular sola es incapaz de restablecer la citoarquitectura de las vías axonales dañadas o perdidas. Un enfoque alternativo que aborda los problemas que enfrentan las estrategias de entrega de células y fármacos / sustancias químicas es la combinación de estos enfoques con el uso de biomateriales 14 , 22 , 23 . Los biomateriales tales como hidrogeles son capaces de emular las propiedades bioquímicas y físicas de la matriz extracelular (ECM), ayudando en la liberación celularD retención dentro de la zona lesionada, y la entrega de factores de crecimiento y otras moléculas bioactivas con liberación controlada [ 22] . Las características atractivas de estas estrategias basadas en el biomaterial han dado como resultado evidencia de regeneración axonal in vivo tras el trasplante de andamios al área lesionada 24 , 25 , 26 , 27 , 28 , 29 , 30 . Sin embargo, las estrategias de biomateriales acelulares no reemplazan a las neuronas perdidas; Cuando se usan como vehículos de suministro para células precursoras neuronales, gliales o neuronales, los biomateriales son incapaces de reconstituir redes axonales de larga distancia. El desafío de desarrollar un enfoque que aborda tanto la degeneración de la vía axonal como la pérdida neuronal asociada con lesión y enfermedad del SNC sigue siendo <Sup class = "xref"> 31.
Nuestro grupo de investigación informó anteriormente el desarrollo de implantable micro-tejidos ingeniería redes neuronales (micro-TENNs), que son un tipo de "andamiaje" que consiste en cuerpos de células neuronales restringido a uno o ambos extremos de un agarose hidrogel-ECM microc columna , Con tramos axonales alineados que se extienden a lo largo del interior de este encajonamiento tridimensional (3D) 1 , 10 , 31 , 32 . Una de las principales diferencias entre esta técnica y los enfoques anteriores es que la citoarquitectura de los micro-TENNs se crea completamente in vitro y se trasplanta después 33 , 34 , 35 , 36 , 37 , 38 ,Sup class = "xref"> 39 , 40 , 41 . La fabricación in vitro ofrece un amplio control espacial y temporal del fenotipo y orientación celular, propiedades mecánicas / físicas, señales bioquímicas y factores exógenos, lo que beneficia la integración de estos andamios con el huésped después de la implantación 41 , 42 . Los micro-TENNs son anatómicamente inspirados porque emulan la neuroanatomía del cerebro, mostrando tramas axonales similares a las que unen distintas regiones funcionales del cerebro ( Figura 1A ) 1 . Por lo tanto, esta estrategia puede ser capaz de reemplazar físicamente los tractos de la materia blanca perdida y las neuronas después de la implantación en una región lesionada. Esta técnica también está inspirada en mecanismos de desarrollo en los que los "andamios naturales" formados por células gliales radiales y axones pioneros actúan como guías de trayectoria para célulasMigración desde la zona subventricular y el crecimiento axonal, respectivamente 43 . Estos mecanismos se recapitulan en los tramos axonales alineados de micro-TENNs, que puede presentar las vías vivas para la migración de células neuronales y la regeneración axonal por Axon mediada axonal outgrowth ( Figura 1C ] [ 43] . Además, esta estrategia aprovecha la integración sináptica entre las neuronas micro-TENN y los circuitos nativos, formando nuevos relés que pueden contribuir a la recuperación funcional ( Figura 1B ) [ 43] . La capacidad de formación de sinapsis también puede conceder a este enfoque la capacidad de modular el SNC y responder al tejido del huésped de acuerdo con la retroalimentación de la red. Por ejemplo, las neuronas optogeneticamente activas en los andamios vivos pueden ser estimuladas para modular las neuronas huésped a través de interacciones sinápticas ( Figura 1D ).
Además, la estructura tubular basada en el biomaterialEl desarrollo de micro-TENNs ofrece un ambiente adecuado para la adhesión celular, el crecimiento, la extensión neurítica y la señalización, mientras que las dimensiones en miniatura de las construcciones permiten potencialmente una implantación mínimamente invasiva y proporcionan un microenvimiento parcialmente secuestrado para la integración gradual en el cerebro. De hecho, publicaciones recientes han demostrado el potencial de micro-TENNs para imitar las vías neurales después de la implantación en el cerebro de rata. Después de la microinyección estereotáxica, hemos informado anteriormente la evidencia de micro-TENN supervivencia neuronal, el mantenimiento de la arquitectura del tracto axonal, y la extensión neurita en la corteza del anfitrión a por lo menos 1 mes in vivo [ 10 , 31] . Además, el etiquetado con sinapsina proporcionó evidencia histológica de integración sináptica con tejido nativo 10 , 31 . En general, los micro-TENN pueden ser especialmente adecuados para reconstruir y modular los dañosCNS sustituyendo las neuronas perdidas, integrándose sinápticamente con los circuitos del huésped, restaurando la citoarquitectura axonal perdida y, en ciertos casos, proporcionando axones regeneradores con las señales de detección de trayectos apropiadas.
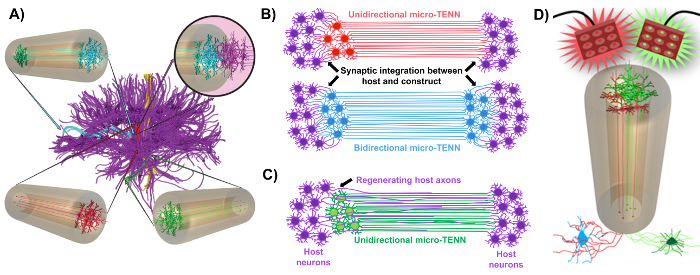
Figura 1: Principios e inspiración detrás del desarrollo de redes neuronales de ingeniería micro-tejidos (micro-TENNs). ( A ) Los micro-TENNs imitan la citoarquitectura de la conexión cerebral (púrpura), en la cual regiones funcionalmente distintas están conectadas por largos tramos axonales alineados de una manera unidireccional (rojo, verde) o bidireccional (azul). A modo de ejemplo, los micro-TENNs podrían reconstituir las conexiones perdidas en las vías corticotalámica y nigroestriatal o en la vía perforante desde la corteza entorrinal al hipocampo (adaptado de Struzyna et al. , 2015) 1 . ( B ) Diagrama de una unidireccionL y micro-TENN bidireccional (rojo y azul, respectivamente) que se integran sinápticamente con el circuito del anfitrión (morado) para servir como un relé funcional entre ambos extremos de una lesión. ( C ) Esquema de los tractos axonales de un micro-TENN unidireccional (verde) que sirve como guía para la regeneración axónica facilitada de los axones del huésped (púrpura) hacia un objetivo con el que interactúa el micro-TENN. ( D ) Diagrama conceptual del uso de micro-TENNS optogeneticamente activos como neuromoduladores, aprovechando la integración sináptica con neuronas excitadoras o inhibidoras (parte inferior). Haga clic aquí para ver una versión más grande de esta figura.
El manuscrito actual detalla la metodología utilizada para fabricar micro-TENNs usando neuronas corticales cerebrales derivadas de forma embrionaria. Cabe destacar que los micro-TENN podrían fabricarse con otros tipos de células neurales. Por ejemploAmpliamente, los informes iniciales del desarrollo exitoso de micro-TENN incluyeron neuronas del ganglio de la raíz dorsal (DRG) 32 . Las microcolumnas de hidrogel pueden ser generadas ( Figura 2A ) añadiendo agarosa líquida a un conjunto de canales cilíndrico cortado por láser hecho a medida oa tubos capilares, conteniendo ambos agujas de acupuntura alineadas. La aguja forma el lumen y determina el diámetro interior (ID) de la micro-columna, mientras que el ID del tubo capilar y el diámetro de los cilindros en el dispositivo de corte por láser dictan el diámetro exterior (DO) de las construcciones. La DO y la ID se pueden elegir de acuerdo con la aplicación deseada seleccionando diferentes diámetros para los tubos de dispositivo / capilar y las agujas de acupuntura, respectivamente. La longitud de las micro-columnas también se puede variar; Hasta la fecha, hemos informado de la construcción de micro-TENNs de hasta 20 mm de longitud 10 y están buscando activamente longitudes aún más largas. Después de los geles de agarosa y la acupuntura nSe retiran las eedles, se añade una solución ECM que consiste generalmente en colágeno tipo I y laminina en el lumen de las construcciones ( Figura 2C ). El núcleo de ECM proporciona un andamio para soportar la adhesión de células neuronales y el crecimiento axonal. Inicialmente, las neuronas corticales de rata primaria se colocaron en las micro-columnas utilizando suspensiones de células disociadas [ 10 , 31 , 32] . Sin embargo, este enfoque no produjo la citoarquitectura objetivo en todos los casos, que se definió como los cuerpos celulares neuronales restringidos a los extremos de las micro-columnas, con la luz central compuesta de puros alineados axonal tracts. Desde entonces, el uso de un método de agregación neuronal forzada (basado en protocolos adaptados de Ungrin et al .) Ha permitido una fabricación más fiable y consistente de micro-TENNs con la estructura ideal ( Figura 2B ] [ 44] . Además de describir las, Este artículo mostrará contraste de fase representativo y imágenes confocales de micro-TENNs que demuestran la formación de tractos axonales a lo largo del tiempo, así como la citoarquitectura objetivo final. Este manuscrito también se ampliará en los aspectos notables del protocolo y los desafíos restantes y las direcciones futuras de la tecnología micro-TENN.
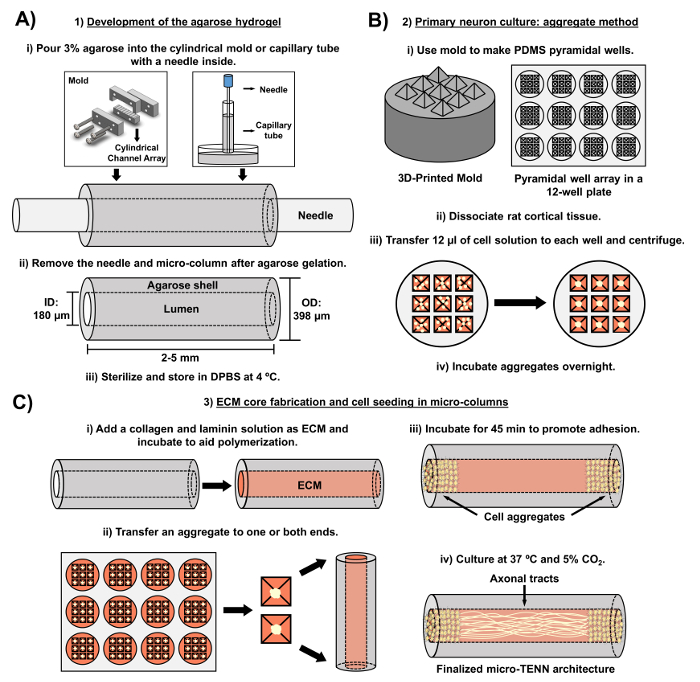
Figura 2: Diagrama esquemático del proceso de fabricación de micro-TENN en tres etapas. ( A ) Desarrollo del hidrogel de agarosa: (i) Inicialmente, se inserta una pequeña aguja de acupuntura ( por ejemplo , 180-350 μm de diámetro) en los canales cilíndricos de un molde moldeado por láser hecho a medida o un tubo capilar ( por ejemplo, , 380 – 700 mu m de diámetro). En el paso siguiente, la agarosa líquida en DPBS se introduce en los canales cilíndricos o tubos capilares. (Ii) Después de los geles de agarosa, se retira la aguja yEl molde se desmonta para producir las microcolumnas huecas de agarosa. (Iii) Estas construcciones se esterilizan a continuación y se almacenan en DPBS. ( B ) Cultivo de neuronas primarias y el método agregado: (i) La agregación neuronal se realiza en matrices de pocillos piramidales, moldeados a partir de moldes impresos en 3D, que encajan en los pocillos de una placa de cultivo de 12 pocillos. (Ii) Los micro-TENN incluyen neuronas primarias de rata disociadas de cerebros fetales de ratas día 18 embrionarias. Después de la disociación tisular con tripsina-EDTA y DNasa I, se prepara una solución celular con una densidad de 1,0-2,0 x 106 células / ml. (Iii) se transfieren 12 μl de esta solución a cada pocillo de la matriz de pocillos piramidales. La placa que contiene estos micro pocillos se centrifuga para producir agregados celulares. (Iv) Estos se incuban a continuación durante la noche antes del chapado en las microcualas. ( C ) Fabricación de núcleos de ECM y siembra de células: (i) Antes de la siembra de células, una solución de ECM que contiene 1 mg / ml de colágeno tipo I y 1 mg / mlLaminina se transfiere al interior de los micro-TENNs y se deja polimerizar. (Ii) Dependiendo de si se están fabricando micro-TENNs unidireccionales o bidireccionales, un agregado se coloca en uno o ambos extremos de la micro-columna, respectivamente. (Iii) Después de un período de incubación para promover la adhesión, los micro-TENN se cultivan en placas de Petri inundadas con un medio basal neuronal embrionario suplementado. (Iv) Después de 3-5 días en cultivo, la estructura final del micro-TENN debe demostrar los agregados celulares en los extremos de la micro-columna, con los tractos axonales que abarcan su longitud. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Las lesiones y enfermedades del SNC típicamente dan como resultado la pérdida o disfunción de las vías axonales de larga distancia que comprenden el conector cerebral, con o sin degeneración neuronal concomitante. Esto se ve agravado por la limitada capacidad del SNC para promover la neurogénesis y la regeneración. A pesar de la búsqueda de estrategias de reparación como el factor de crecimiento, la célula y el suministro de biomateriales como abordajes individuales o combinatorias, estas técnicas no son capa…
Disclosures
The authors have nothing to disclose.
Acknowledgements
El apoyo financiero fue proporcionado por los Institutos Nacionales de Salud U01-NS094340 (Cullen), T32-NS043126 (Harris) y F31-NS090746 (Katiyar)), la Fundación Michael J. Fox (Therapeutic Pipeline Program # 9998 (Cullen) El Premio Piloto del Centro de Neurociencias de Penn Medicine (Cullen), la Fundación Nacional de Ciencias (Becas de Investigación de Postgrado DGE-1321851 (Struzyna y Adewole)), el Departamento de Asuntos de Veteranos (Revista de Mérito de RR & D # B1097-I (Cullen) De Cirujanos Neurológicos y el Congreso de Cirujanos Neurológicos (Beca Codman 2015-2016 en Neurotrauma y Cuidados Críticos (Petrov)), y el Comando de Investigación Médica y Material del Ejército de los Estados Unidos (W81XWH-13-207004 (Cullen) y W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

