Anatomisk inspirerte tredimensjonale mikrovev-konstruerte nevrale nettverk for nervesystemet Rekonstruksjon, modulering og modellering
Summary
Dette manuskriptet beskriver fremstillingen av mikrovev-manipulerte nevrale nettverk: tredimensjonale mikronstørrelses konstruksjoner bestående av langjusterte aksonale kanaler som spenner over aggregerte nevronpopulasjoner som er innkapslet i en rørformet hydrogel. Disse levende stillasene kan fungere som funksjonelle reléer for å rekonstruere eller modulere nevrale kretser eller som biofideliske test-senger som etterligner grå-hvitt materie-neuroanatomi.
Abstract
Funksjonell gjenoppretting forekommer sjelden etter skade eller sykdomsfremkalt degenerasjon i sentralnervesystemet (CNS) på grunn av det hemmende miljø og den begrensede kapasiteten for neurogenese. Vi utvikler en strategi for samtidig å behandle nevron- og axonal baneutslipp i det skadede CNS. Dette manuskriptet presenterer fremstillingsprotokollen for mikro-vev-konstruerte nevrale nettverk (mikro-tenner), implanterbare konstruksjoner som består av nevroner og justerte aksonale kanaler som spenner over den ekstracellulære matriksen (ECM) lumen av en forformet hydrogelcylinder, hundrevis av mikron i diameter som kan utvide sentimeter I lengde. Neuronale aggregater er avgrenset til ekstremer av den tredimensjonale innkapslingen og spennes av aksonale fremspring. Mikro-tenner er unikt posisjonert som en strategi for CNS rekonstruksjon, emulerende aspekter av hjernekobling cytoarchitecture og potensielt gir midler for nettverksutskifting. Den neuRonale aggregater kan synaps med vertsvev for å danne nye funksjonelle reléer for å gjenopprette og / eller modulere manglende eller skadet kretsløp. Disse konstruksjonene kan også fungere som pro-regenerative "levende stillas" som er i stand til å utnytte utviklingsmekanismer for celle-migrasjon og aksonal pathfinding, som gir synergistiske strukturelle og løselige signaler basert på regenereringsstatus. Mikro-tenner fremstilles ved å helle flytende hydrogel inn i en sylindrisk form som inneholder en langsgående sentrert nål. Når hydrogelen har gelert, blir nålen fjernet, og etterlater en hul mikrokolonne. En ECM-løsning legges til lumenet for å gi et miljø egnet for nevronal adhesjon og aksonal utvekst. Dissocierte nevroner er mekanisk aggregerte for presis sådd i en eller begge ender av mikrokolonnen. Denne metoden gir pålitelig selvbetjente miniatyrkonstruksjoner med langprojiserende aksonale kanaler som kan rekapitulere trekkegenskaper i hjernens neuroanatomi. Synaptisk immUnolabeling og genetisk kodede kalsiumindikatorer antyder at mikro-tenner har omfattende synaptisk fordeling og inneboende elektrisk aktivitet. Følgelig representerer mikro-tennene en lovende strategi for målrettet nevrokirurgisk rekonstruksjon av hjerneveier, og kan også brukes som biofideliske modeller for å studere neurobiologiske fenomener in vitro .
Introduction
En vanlig egenskap for lidelser og sykdommer i sentralnervesystemet (CNS), som traumatisk hjerneskade (TBI), ryggmargsskade (SCI), hjerneslag, Alzheimers sykdom og Parkinsons sykdom, er frakoblingen av aksonale veier og nevroncelle Tap 1 , 2 , 3 , 4 , 5 , 6 . For eksempel, når et iskemisk slag går ubehandlet, anslås det at aksonene går tapt med en hastighet på 7 miles av axoner per minutt 5 . I tilfelle av TBI, som ca 1,7 millioner mennesker opplever hvert år i USA alene, kan aksonal degenerasjon fortsette å skje år etter traumer, da den første skaden utsettes for en langsiktig neurodegenerativ tilstand 4 . Forverrer disse skadelige effektene, har CNS en alvorlig begrenset capaBy for regenerering 1 , 7 , 8 , 9 . Etter skader utvikles et hemmende miljø som er preget av mangel på rettet veiledning til fjerne mål, tilstedeværelsen av myelin-assosierte hemmere som hindrer nevittutvæksten, og dannelsen av et glialær ved reaktive astrocytter 8 , 10 , 11 , 12 . Glialæret tjener som en biokjemisk og fysisk barriere for regenerering, med molekyler som kondroitinsulfatproteoglykaner som hindrer aksonutvokst 8 , 11 . Videre, selv om neurale stamceller er blitt funnet i den voksne CNS, er produksjonen av nye nevroner begrenset, da konsekvent bevis på nevrogenese kun er funnet i olfaktorisk pære, hippocampalSubgranulær sone, det periventrikulære området og den sentrale kanal i ryggmargen 13 , 14 . Disse hindringene hindrer den funksjonelle gjenoppretting av tapt nevroner og hvit materiell arkitektur etter skade eller sykdom, noe som resulterer i de ofte endringsmessige og langvarige effektene av disse forholdene.
Til tross for mangel på regenerativ kapasitet i den voksne CNS, har det vist seg at aksonal regenerering er mulig dersom tilstrekkelige miljøveiledninger presenteres for verten nevroner 15 , 16 , 17 , 18 . Forskere har forsøkt å levere og manipulere vekstfaktorer (for eksempel nervevækstfaktor, epidermal vekstfaktor, glialavhengig vekstfaktor og nevrotrofisk faktor 3) og andre veiledningsmolekyler for å stimulere plastisitet og axonregenerering 14 , </ Sup> 18 , 19 . Selv om disse studiene har bekreftet at voksenaksoner er i stand til å reagere på vekstfaktorer, er disse strategiene begrenset av lavt gjennomtrengelighet av blod-hjernebarrieren og de spesifikke romlige og tidsmessige gradienter som kreves for å fremme regenerering 14 , 18 , 19 . Andre tilnærminger har stått på hyperaktivering av regenereringsrelaterte transkripsjonsfaktorer i CNS-neuroner. For eksempel stimulerte overekspresjon av Stat3 transkripsjonsfaktoren aksonal regenerering i optisk nerve 20 . Likevel unnlater både biomolekylavgivelse og overekspresjon av transkripsjonsfaktorer å erstatte tapte nevronpopulasjoner. Cell-baserte strategier har hovedsakelig sentrert seg på transplantasjon av neuralstamceller (NSC) i CNS, og utnytter deres evne til å erstatte CNS-neuroner, frigjøre trofiske faktorer,Og støtte forsøk på neurogenese som oppstår etter skade 17 . Til tross for dette er det fortsatt presserende utfordringer som hindrer denne tilnærmingen, inkludert den hindrede evne til transplanterte nevrale celler til å overleve, integrere med verten, og forblir romlig begrenset til det skadede område 6 , 14 , 17 , 21 . I tillegg er cellelevering alene ikke i stand til å gjenopprette cytoarkitekturen av skadede eller tapte aksonale veier. En alternativ tilnærming som løser problemene med celle- og stoff- / kjemisk leveringsstrategier, er å kombinere disse tilnærmingene med bruken av biomaterialene 14 , 22 , 23 . Biomaterialer som hydrogeler er i stand til å emulere de biokjemiske og fysiske egenskapene til den ekstracellulære matriksen (ECM), som bidrar til cellelevering ogD oppbevaring i det skadede området, og levere vekstfaktorer og andre bioaktive molekyler med kontrollert frigivelse 22 . De attraktive egenskapene til disse biomaterialebaserte strategiene har resultert i bevis på in vivo axonal regenerering etter transplantasjon av stillaser til det lesioned området 24 , 25 , 26 , 27 , 28 , 29 , 30 . Imidlertid erstatter acellulære biomaterialestrategier ikke tapte nevronpopulasjoner; Når de brukes som leveringsvogner for nevron-, glial- eller neuronprekursorceller, er biomaterialer ikke i stand til å rekonstruere langdistansaksonale nettverk. Utfordringen med å utvikle en tilnærming som takler både den aksonale banedegenerasjonen og nevrolog tap forbundet med CNS-skade og sykdom forblir fortsatt <Sup class = "xref"> 31.
Vår forskningsgruppe rapporterte tidligere utviklingen av implanterbare mikro-vev-konstruerte nevrale nettverk (mikro-tenner), som er en type "levende stillas" bestående av neuronelle celleorganer begrenset til en eller begge ender av en agarosehydrogel-ECM mikrosøjle , Med justerte aksonale kanaler som strekker seg gjennom det indre av denne tredimensjonale (3D) innkapslingen 1 , 10 , 31 , 32 . En av de viktigste forskjellene mellom denne teknikken og tidligere tilnærminger er at cytoarkitektur av mikro-tenner er opprettet helt in vitro og transplanteres etterpå 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . In vitro- fremstilling gir omfattende romlig og tidsmessig kontroll av cellulær fenotype og orientering, mekaniske / fysiske egenskaper, biokjemiske tegn og eksogene faktorer, noe som fordeler integrasjonen av disse stillasene med verten etter implantasjon 41 , 42 . Mikro-tenner er anatomisk inspirert fordi de etterligner hjernens neuroanatomi, viser aksonale kanaler som ligner de som knytter distinkte funksjonsområder av hjernen ( figur 1A ) 1 . Derfor kan denne strategien fysisk erstatte tapte hvite materielle kanaler og nevroner etter implantasjon i en lesioned region. Denne teknikken er også inspirert av utviklingsmekanismer der "naturlige levende stillaser" dannet av radiale glialceller og banebrytende axoner fungerer som veiledende guider for celleMigrasjon fra subventricular sonen og aksonal utvekst, henholdsvis 43 . Disse mekanismene er rekapitulert i de justerte aksonale kanaler av mikro-tenner, som kan presentere levende veier for nevralcellemigrasjon og aksonal regenerering ved akson-mediert aksonal utvekst ( figur 1C ) 43 . Videre utnytter denne strategien seg av synaptisk integrasjon mellom mikro-TENN-neuronene og det nasjonale kretsløpet, og danner nye reléer som kan bidra til funksjonell gjenoppretting ( figur 1B ) 43 . Kapasiteten til synapsdannelse kan også gi denne tilnærmingen muligheten til å modulere CNS og reagere på vertsvev i henhold til nettverks tilbakemelding. For eksempel kan optogenetisk aktive nevroner i levende stillasene stimuleres til å modulere vertsneuroner gjennom synaptiske interaksjoner ( Figur 1D ).
I tillegg er den biomaterialebaserte rørformede konstrUgn av mikro-tenner gir et tilstrekkelig miljø for celleadhesjon, vekst, neurittforlengelse og signalering, mens de minste dimensjonene av konstruksjonene muligens muliggjør minimal invasiv implantering og gir et delvis sekvestrert mikromiljø for gradvis integrering i hjernen. Faktisk har nyere publikasjoner vist potensialet for mikro-tenner til å etterligne nevrale veier etter implantasjon i rottehjerne. Etter stereotaksisk mikroinjeksjon rapporterte vi tidligere bevis for mikro-TENN-neuronal overlevelse, vedlikehold av aksonalkanalarkitektur, og nevittforlengelse i vertscortexen i minst 1 måned in vivo 10 , 31 . Dessuten ga merking med synapsin histologisk bevis på synaptisk integrasjon med nativt vev 10 , 31 . Samlet sett kan mikro-tenner være unikt egnet til å rekonstruere og modulere skadetCNS ved å erstatte tapte nevroner, synaptisk integrering med vertskretsløp, gjenopprette tapt axonal cytoarkitektur og i visse tilfeller å gi regenererende axoner med de riktige stikkordene.
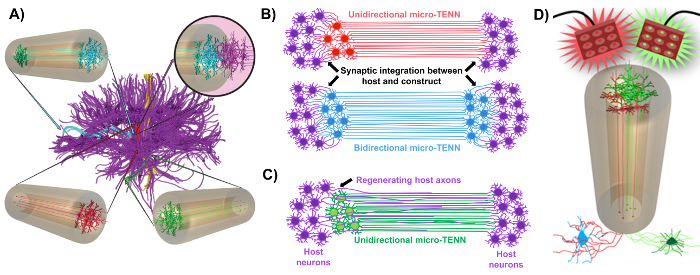
Figur 1: Prinsipper og inspirasjon bak utviklingen av mikro-vev-konstruerte nevrale nettverk (mikro-tenner). ( A ) Mikro-Tenner etterligner cytoarkitekturen til hjernekoblingen (lilla), hvor funksjonelt forskjellige regioner er forbundet med lange, justerte aksonale kanaler i en retningsriktet (rød, grønn) eller toveis (blå) måte. Som et eksempel kan mikro-tenner rekonstruere tapte forbindelser i kortikothalamiske og nigrostriatale veier eller i perforantveien fra entorhinal cortex til hippocampus (tilpasset fra Struzyna et al. , 2015) 1 . ( B ) Diagram over en enhetlig retningL og toveis mikro-TENN (henholdsvis rød og blå) synaptisk integrering med vertskretsen (lilla) for å fungere som et funksjonsrelé mellom begge ender av en lesjon. ( C ) Skjematisk av axonaltraktene i en ensrettet mikro-TENN (grønn) som tjener som en veiledning for aksonforenklet regenerering av vertsaxoner (lilla) mot et mål som mikro-tennene samhandler med. ( D ) Konseptbasert diagram for bruk av optogenetisk aktive mikro-TENNS som nervemodulatorer, utnytte synaptisk integrasjon med eksitatoriske eller hemmerende nevroner (bunn). Vennligst klikk her for å se en større versjon av denne figuren.
Det nåværende manuskriptet beskriver metoden som ble benyttet for å fremstille mikro-tenner ved bruk av embryonalt avledede cerebrale kortikale nevroner. Spesielt kan mikro-tenner fremstilles med andre typer nevrale celler. For eksempelRikelig, de første rapportene om vellykket mikro-TENN-utvikling inneholdt dorsal root ganglion (DRG) nevroner 32 . Hydrogelmikrokolonnene kan genereres ( figur 2A ) ved å tilsette flytende agarose til en skreddersydd, laser-kuttet sylindrisk kanalgruppe eller til kapillærrør, begge inneholdende justerte akupunkturnåler. Nålen danner lumenet og bestemmer mikrokolonnens indre diameter (ID), mens kapillærrøret ID og diameteren av sylindrene i den laserskårne anordningen dikterer den ytre diameter (OD) til konstruksjonene. OD og ID kan velges i henhold til ønsket søknad ved å velge forskjellige diametre for henholdsvis anordning / kapillærrør og akupunktur nåler. Lengden på mikrokolonnene kan også varieres; Til dags dato har vi rapportert bygging av mikro-tenner opptil 20 mm i lengde 10 og driver aktivt lengre lengder. Etter agarose geler og akupunktur nEedler fjernes, en ECM-løsning som vanligvis består av type I kollagen og laminin tilsettes i konstruksjonslumenet ( figur 2C ). ECM-kjernen gir et stillas for å understøtte nevroncelleadhesjon og aksonal utvekst. I første omgang ble primære rotte-kortikale nevroner plettet i mikrokolonnene ved anvendelse av dissocierte cellesuspensjoner 10 , 31 , 32 . Imidlertid produserte denne tilnærmingen ikke mål-cytoarkitekturen i alle tilfeller, som ble definert som neuronelle celleorganer begrenset til endene av mikrokolonnene, med det sentrale lumen bestående av renjusterte aksonale kanaler. Siden da har bruken av en tvungen neuronal aggregeringsmetode (basert på protokoller tilpasset Ungrin et al .) Gjort det mulig for en mer pålitelig og konsekvent fremstilling av mikro-tenner med den ideelle strukturen ( figur 2B ) 44 . I tillegg til å beskrive dagensMetodikk, vil denne artikkelen vise representative fasekontrast og konfokale bilder av mikro-tenner som demonstrerer dannelsen av aksonale kanaler over tid, samt den ferdige mål-cytoarkitekturen. Dette manuskriptet vil også utvide på bemerkelsesverdige aspekter av protokollen og gjenværende utfordringer og fremtidige retninger av mikro-TENN teknologien.
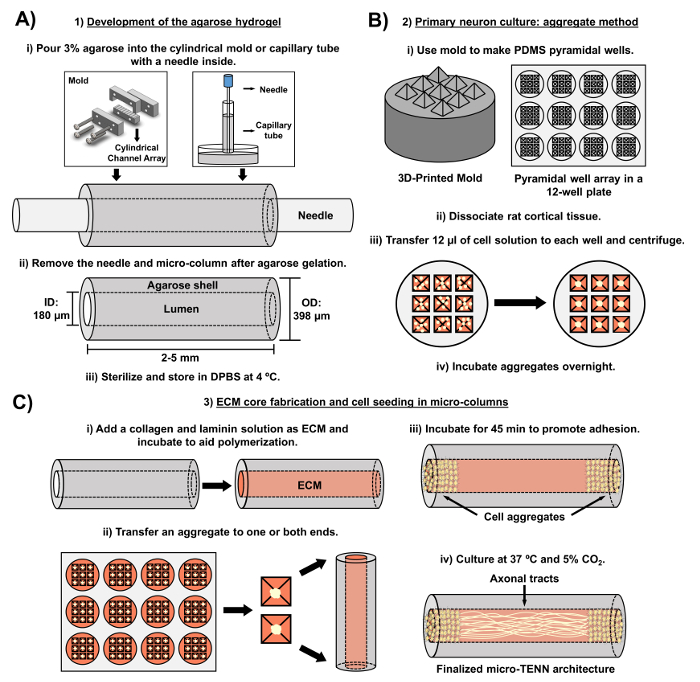
Figur 2: Skjematisk diagram av tre-trinns mikro-TENN fabrikasjonsprosess. ( A ) Utvikling av agarosehydrogelen: (i) Først settes en liten akupunkturnål ( f.eks . 180-350 μm i diameter) inn i de sylindriske kanalene i en skreddersydd, laserskåret form eller et kapillarrør ( f.eks. , Diameter 380-700 μm). I det neste trinnet blir flytende agarose i DPBS introdusert i de sylindriske kanalene eller kapillærrørene. (Ii) Etter agarose gelene fjernes nålen ogFormen er demontert for å gi de hule agarosemikolonner. (Iii) Disse konstruksjonene steriliseres deretter og lagres i DPBS. ( B ) Primærnekonkultur og aggregatmetode: (i) Neuronal aggregering utføres i pyramidale mikrobrønn-arrays, støpt av 3D-trykte støper, som passer inn i brønnene på en 12-brønn kulturplate. (Ii) Mikro-TENNer inkluderer primære rotte-neuroner dissosiert fra føtalhjerner av embryonaldag-18-rotter. Etter vevsdissociasjon med trypsin-EDTA og DNase I fremstilles en celleoppløsning med en densitet på 1,0-2,0 x 106 celler / ml. (Iii) 12 μl av denne løsningen overføres til hver brønn i den pyramide mikrobrønn array. Platen som inneholder disse mikrobrønnene, blir sentrifugert for å produsere celleaggregater. (Iv) Disse inkuberes deretter over natten før plating i mikrokolonnene. ( C ) ECM-kjernefabrikasjon og cellesøing: (i) Før cellesøing ble en ECM-løsning inneholdende 1 mg / ml type I kollagen og 1 mg / mlLaminin overføres til det indre av mikro-tennene og får lov til å polymerisere. (Ii) Avhengig av om enveis eller toveis mikro-TENN er tilveiebragt, blir et aggregat plassert ved henholdsvis en eller begge ytterpunkter av mikrokolonnen. (Iii) Etter en inkuberingsperiode for å fremme vedheft blir mikro-TENN dyrket i petriskåler oversvømt med supplert embryonalt nevronbasalt medium. Iv) Etter 3-5 dager i kultur bør den endelige mikro-TENN-strukturen demonstrere celleaggregater ved ekstremer av mikrokolonnen, med aksonale kanaler som strekker seg over lengden. Vennligst klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
CNS-skade og sykdom resulterer vanligvis i tap eller dysfunksjon av langdistansaksonalbanene som omfatter hjernekoblingen, med eller uten samtidig neuronal degenerasjon. Dette forsterkes av den begrensede kapasiteten til CNS for å fremme neurogenese og regenerering. Til tross for jakten på reparasjonsstrategier som vekstfaktor, celle og biomateriallevering som individuelle eller kombinatoriske tilnærminger, feiler disse teknikkene samtidig ikke for både degenerasjonen av nevronceller og tapet av aksonale forbindelse…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Finansiell støtte ble gitt av National Institute of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) og F31-NS090746 (Katiyar)), Michael J. Fox Foundation (Therapeutic Pipeline Program # 9998 (Cullen)), Penny Medicine Neuroscience Center Pilot Award (Cullen), National Science Foundation (Graduate Research fellowships DGE-1321851 (Struzyna og Adewole)), Department of Veterans Affairs (RR & D Merit Review # B1097-I (Cullen)), American Association Av neurologiske kirurger og kongress for neurologiske kirurger (Codman-fellesskapet i Neurotrauma og Critical Care, 2015-2016) og US Army Medical Research and Materials Command (# W81XWH-13-207004 (Cullen) og W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

