Spatiotemporally gecontroleerde nucleaire translocatie van gasten in levende cellen gekooide moleculaire lijm als Photoactivatable Tags gebruiken
Summary
Dit protocol beschrijft licht geactiveerd nucleaire translocatie van gasten in levende cellen met behulp van gekooide moleculaire lijm tags. Deze methode is veelbelovend voor site-selectieve nucleaire-targeting drug delivery.
Abstract
De celkern is een van de belangrijkste organellen als subcellular drug-levering doel, sinds modulatie van gene replicatie en expressie is effectief voor de behandeling van verschillende ziekten. Hier tonen we licht geactiveerd nucleaire translocatie van gasten met behulp van moleculaire lijm (GlueCaged-R) tags, waarvan meerdere guanidinium ion (Gu+) Hangers worden beschermd door een groep van de anionactieve photocleavable (butyraat-gesubstitueerde gekooide nitroveratryloxycarbonyl; BA NVOC). Gasten gelabeld met Cagedlijm-R worden overgenomen in levende cellen via endocytose en blijven Endosomen. Echter, op photoirradiation, Cagedlijm-R wordt omgezet in uncaged moleculaire lijm (Glue-RUncaged) uitvoering van meerdere Gu+ Hangers, dat de endosomal vlucht en de daaropvolgende nucleaire translocatie van de gasten vergemakkelijkt. Deze methode is veelbelovend voor site-selectieve nucleaire-targeting drug levering, aangezien de tagged gasten naar het cytoplasma gevolgd door de celkern migreren kunnen alleen als photoirradiated. Caged Lijm-R tags kunnen leveren macromoleculaire gasten zoals quantumdots (QDs) evenals kleine-molecuul gasten. Caged Lijm-R tags kunnen uncaged met niet alleen UV-licht, maar ook twee-foton nabij-infrarood (NIR) licht, dat diep in weefsel kan binnendringen.
Introduction
De celkern, die genetische informatie draagt, is een van de belangrijkste organellen als subcellular drug-levering doel, sinds modulatie van gene replicatie en expressie is effectief voor de behandeling van verschillende ziekten waaronder kanker en genetische stoornissen van1,2,3. Voor nucleaire levering van drugs, vervoeging van peptide tags zoals nucleaire localisatie signalen (NLS)4,5,6 grote schaal is onderzocht. Ter beperking van ongewenste bijwerkingen hebben, is echter de spatio controle van de nucleaire translocatie nodig.
Eerder, licht-geactiveerd translocatie van eiwitten in de celkern heeft bereikt met behulp van gekooide NLS-7,–8,9. NLS worden naar de celkern door binding aan cytoplasmatische vervoer eiwitten6gemigreerd. In de gerapporteerde methoden, zijn gast eiwitten dragen gekooide NLS direct ingelijfd bij het cytoplasma van microinjection8 of uitgedrukt in de doelcellen met behulp van een genetische code uitbreiding techniek9. Een methode die zowel cellulaire opname- en foto-geïnduceerde nucleaire translocatie kan bereiken is dus voordelig voor praktische toepassingen.
Hierin beschrijven we licht geactiveerd nucleaire translocatie van gasten in levende cellen met behulp van dendritische gekooide moleculaire lijm (Cagedlijm-R, Figuur 1) tags. In water oplosbare moleculaire lijm10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 , rekening houdend met meerdere Gu+ Hangers zijn eerder ontwikkeld, die strak houden aan eiwitten11,12,13,14,15, 16,17, nucleïnezuren18,19,20, fosfolipide membranen21en klei nanosheets22,23 via de vorming van meerdere zout bruggen tussen hun Gu+ hangers en oxyanionic groepen op de doelen. De hangers Gu+ van Cagedlijm-R worden beschermd door een anionogene photocleavable groep, butyraat-gesubstitueerde nitroveratryloxycarbonyl (BANVOC). Gasten gelabeld met Cagedlijm-R worden overgenomen in levende cellen via endocytose en verblijf in Endosomen (Figuur 2). Op photoirradiation, zijn de BANVOC groepen Cagedlijm-R zodanig dat deze een uncaged moleculaire lijm (Glue-RUncaged) uitvoering van meerdere Gu+ Hangers, die vervolgens de migratie van de tagged gast vergemakkelijkt vrijstaand in het cytoplasma gevolgd door de celkern (Figuur 2). De Cagedlijm-R tag kan worden uncaged door blootstelling aan UV- of twee-foton nabij-infrarood (NIR) licht zonder ernstige fototoxiciteit. We tonen de spatiotemporally gecontroleerde nucleaire levering van macromoleculaire gasten evenals gasten van de kleine-molecuul met Cagedlijm-R tags, met behulp van quantumdots (QDs) en een fluorescente kleurstof (nitrobenzoxadiazole; NBD), respectievelijk, als voorbeelden.
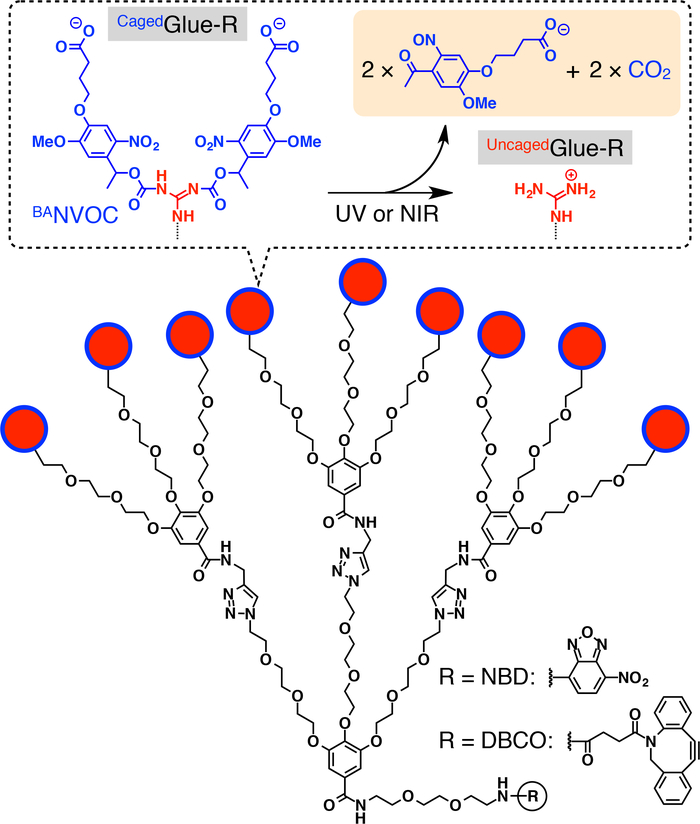
Figuur 1: Schematische structuren van Cagedlijm-R. De 9 guanidinium ion (Gu+) Hangers van Cagedlijm-R worden beschermd door een groep butyraat-gesubstitueerde nitroveratryloxycarbonyl (BANVOC). De BANVOC groepen zijn gekloofd door bestraling met UV- of twee-foton NIR licht. De focal kern van Cagedlijm-R is matiemaatschappij met nitrobenzoxadiazole (NBD) of dibenzocylooctyne (DBCO). Overgenomen met toestemming van referentie20. Klik hier voor een grotere versie van dit cijfer.
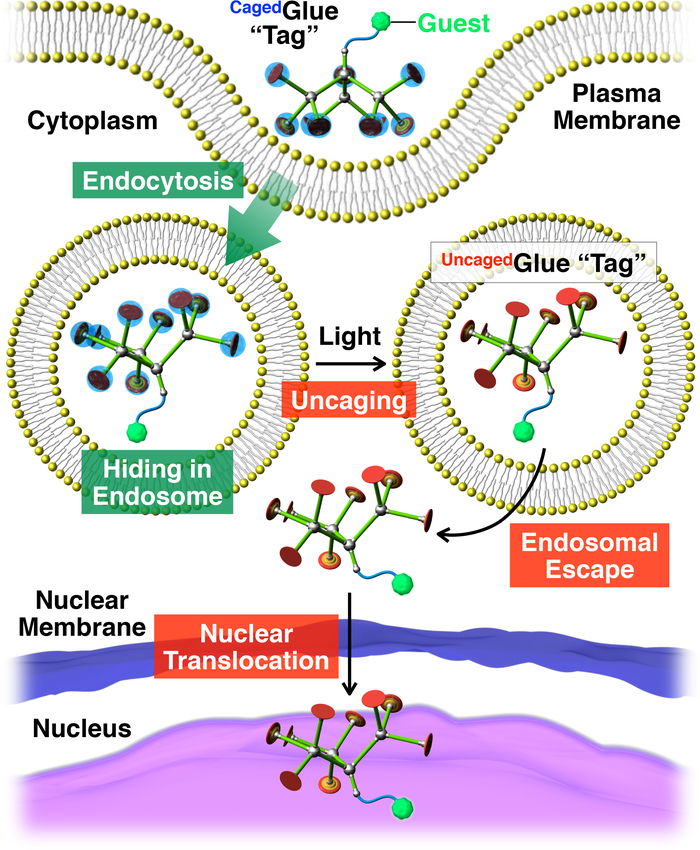
Figuur 2: Schematische afbeelding van licht-geactiveerd nucleaire translocatie van gasten geconjugeerd met een Cagedlijm-R tag. De gast /Cagedlijm-R conjugaat wordt in beslag genomen in levende cellen via endocytosis. Op photoirradiation is de Cagedlijm-R tag uncaged een Uncagedlijm-R tag, die endosomal ontsnappen van de tagged gast vergemakkelijken kan opleveren. Vervolgens worden de tagged gast naar de celkern gemigreerd. Overgenomen met toestemming van referentie20. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
Vorige onderzoeken van licht-geactiveerd translocatie van eiwitten in de celkern hebben bereikt met behulp van gekooide NLS-7,–8,9. Zoals eerder vermeld, vereisen deze methoden additionele technieken te nemen de NLS-gelabelde proteïnen in het cytoplasma. Onze Cagedlijm-R tag kan daarentegen niet alleen foto-geïnduceerde nucleaire translocatie, maar ook cellulaire opname van de gasten. Deze functie van de Caged<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wij erkennen het centrum voor NanoBio integratie, de Universiteit van Tokio. Dit werk was ondersteund door de Grant-in-Aid voor de wetenschappers (B) (26810046) van de jonge aan K.O. en slechts gedeeltelijk ondersteund door Grant-in-Aid speciaal bevorderd onderzoek (25000005) naar T.A. R.M. bedankt de Research Fellowships van Japan Society voor de promotie van wetenschap (JSPS ) voor jonge wetenschappers en het programma voor toonaangevende gediplomeerde scholen (GPLLI).
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

