時空ゲスト活性型タグとしてケージの分子接着剤を用いた生細胞内の核内移行を制御
Summary
このプロトコルでは、ケージ分子接着剤タグを使用して生きている細胞での核内移行を光トリガーについて説明します。このメソッドは、サイト選択的核ターゲット ドラッグデリバリーの有望です。
Abstract
細胞核は、遺伝子の複製の変調から最も重要な細胞内小器官の一つを細胞内薬物送達ターゲットとして、式は様々 な疾患の治療に有効です。ここでは、光トリガー核移行を利用するお客様のケージが複数のためイオン (Gu+) ペンダント (酪酸置換アニオン光分解性グループによって保護されて分子接着剤 (ケージ接着剤 R) タグを紹介します。nitroveratryloxycarbonyl;BANVOC)。ボールリテーナ入り接着剤-R が付いたお客様は生活に取り込まれ、細胞のエンドサイトーシスによってエンドソームのまま。しかし、光照射に伴い、ボールリテーナ入り接着剤-R がアンケージ分子接着剤 (Uncaged接着剤-R) 複数の区+ペンダントを運ぶエンドソーム脱出とゲストの後の核移行を容易にするに変換されます。このメソッドは、タグ付けのお客様は細胞核に続いて細胞質に移行できますので核ターゲット サイト選択の薬物送達のための有望な場合にのみ長。ケージ接着剤 R タグは、小分子のお客様だけでなく、量子ドット (Qd) など高分子のゲストを提供できます。ケージ接着剤 R タグは紫外線だけでなく、組織に深く浸透することができます, 二光子励起近赤外線 (NIR) ライトとケージですることができます。
Introduction
遺伝情報を運ぶ、細胞核の 1 つ最も重要な細胞内小器官細胞内薬物送達ターゲットとして遺伝子複製の変調から式は、がんを含むさまざまな病気の治療に有効と遺伝1,2,3 を障害します。薬のデリバリー、ペプチドの活用は、ような核局在化信号 (NLS)4,5,6が広く検討されているタグを付けます。ただし、望ましくない副作用を減らすために核移行の時空間的制御が必要です。
以前は、ケージ NLS7,8,9を使用して、細胞の核蛋白質の光トリガー転流を実現しています。NLS は、6細胞質輸送タンパク質に結合して細胞核に移行します。報告の方法でケージの NLS を軸受ゲスト蛋白質はマイクロインジェクション8で細胞質に組み込まれてまたは遺伝コードの拡張手法9を使用してターゲット細胞で発現直接。したがって、細胞内取り込みと光誘起核移行を実現できる手法は実用的なアプリケーションのために有利です。
ここで、細胞樹状突起のケージ分子接着 (ボールリテーナ入り接着剤-R は、図 1) タグを使用してお客様の核内移行を光トリガーをについて説明します。水溶性の分子接着剤10、11,12,13,14,15,16,17,18,19,20,21,22,タンパク質11,12,13,14,15、しっかりと接着した23複数区+ペンダントをベアリングが以前開発されています。 16,17, 核酸18,19、20、リン脂質膜21、そして粘土ナノシート22,23を通じて、複数の塩橋区+ペンダントとターゲットにされグループの形成。ボールリテーナ入り接着剤-R の区+ペンダントは光分解性陰イオン グループ、酪酸置換 nitroveratryloxycarbonyl (BANVOC) によって保護されています。ボールリテーナ入り接着剤-R が付いたお客様は生活に取り込まれ、細胞のエンドサイトーシスによってエンドソーム (図 2) でご滞在。光照射に伴い、ボールリテーナ入り接着剤-R のBANVOC グループは、アンケージ分子接着剤 (Uncaged接着剤-R) 複数の区+ペンダントを運ぶタグ ゲストの移行を容易に屈する戸建します。細胞質は細胞核 (図 2) が続きます。ボールリテーナ入り接着剤 R タグが紫外線や深刻な毒性なし二光子励起近赤外線 (NIR) ライトへの露出によってケージですることができます。高分子のお客様だけでなく、小分子ボールリテーナ入り接着剤 R タグ量子ドット (Qd) と蛍光色素 (nitrobenzoxadiazole; を使用してお客様の時空制御の核配信を紹介します。NBD) の例として、それぞれ。
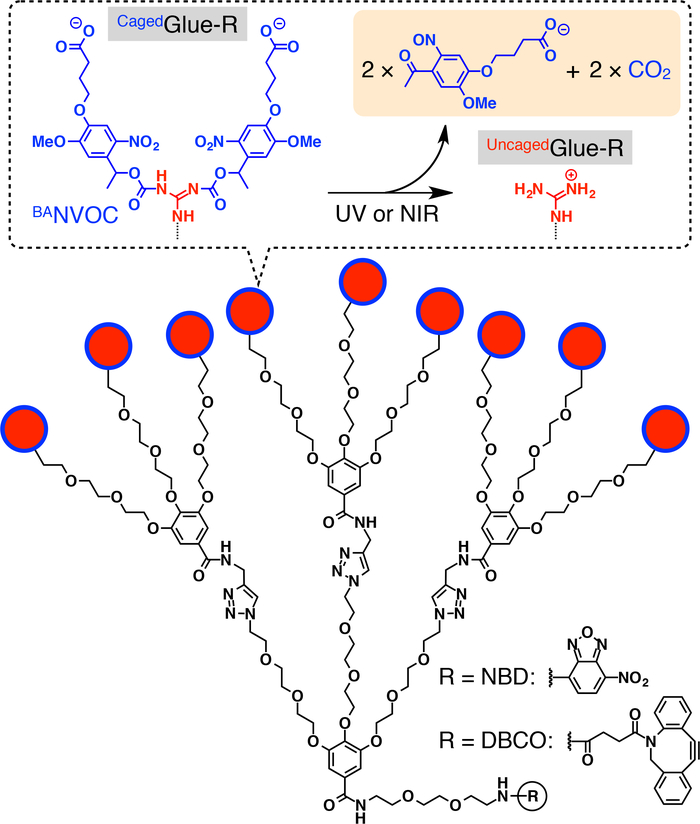
ボールリテーナ入り接着剤-R の図 1: 概略構造ボールリテーナ入り接着剤-R の 9 のためのイオン (Gu+) ペンダントが酪酸置換 nitroveratryloxycarbonyl (BANVOC) グループによって保護されています。BANVOC グループは二光子励起近赤外光照射によって裂かれます。ボールリテーナ入り接着剤研究の焦点のコアは nitrobenzoxadiazole (NBD) または dibenzocylooctyne (DBCO) のいずれかで修飾します。参照20から許可を得て転載。この図の拡大版を表示するのにはここをクリックしてください。
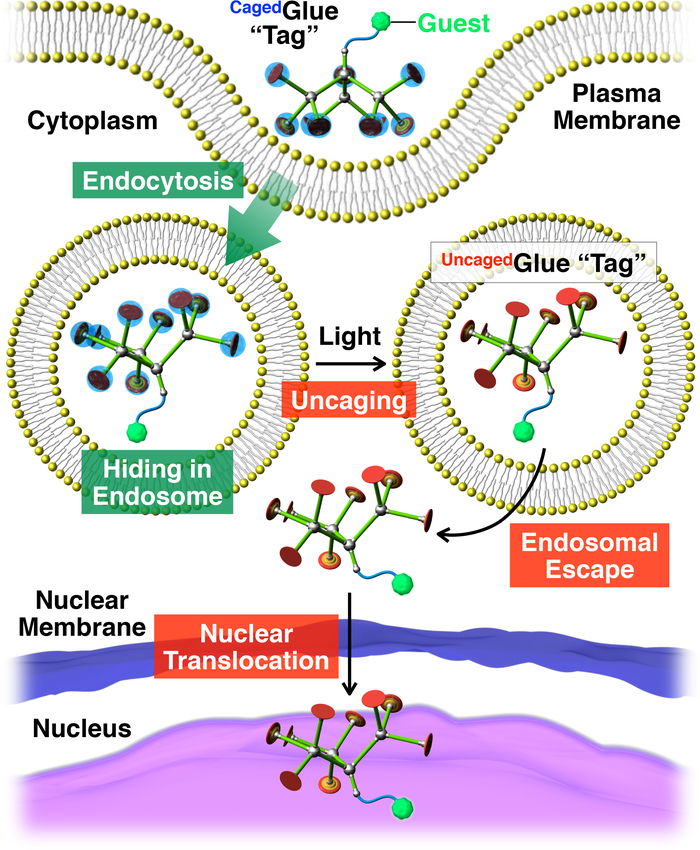
図 2: お客様の核内移行を光トリガーの模式図ボールリテーナ入り接着剤 R タグを持つ共役します。ゲスト/ボールリテーナ入り接着剤 R 共役は生活に取り込まれ、細胞のエンドサイトーシスを介して。光照射に伴い、ボールリテーナ入り接着剤 R タグはタグ ゲストのエンドソーム脱出を容易にすることができますUncaged接着剤 R タグを生成するケージではありません。その後、タグ付けのゲストは、細胞核に移行します。参照20から許可を得て転載。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
タンパク質の光トリガーの転流、細胞の核の前の調査は、ケージ NLS7,8,9を使用して達成されています。前述したように、これらのメソッドに NLS タグ付きタンパク質の細胞質を組み込む付加的な技術が必要です。対照的に、私たちボールリテーナ入り接着剤 R タグにより誘起核移行だけでなく、ゲストの細胞内取?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
ナノバイオの統合、東京の大学中心を認めます。この作品は文部の若手研究 (B) (26810046) k. o. して、部分的にサポート費補助金特別推進研究 (25000005). a. r. m. のおかげで日本社会の研究奨学金のための科学振興) 若手研究者の博士課程教育リーディング (GPLLI) のためのプログラム。
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

