Spatiotemporally controlado translocação Nuclear de convidados em células vivas, usando cola Molecular enjaulada como Photoactivatable Tags
Summary
Este protocolo descreve luz-acionou translocação nuclear de convidados em células vivas, usando tags cola molecular enjaulado. Este método é promissor para a entrega de drogas de nuclear-direcionamento local-seletivo.
Abstract
O núcleo da célula é dentre as organelas mais importantes como um destino de entrega da droga subcellular, desde modulação de replicação de gene e expressão é eficaz no tratamento de várias doenças. Aqui, demonstramos a luz-acionou a translocação nuclear de convidados usando enjaulado tags cola molecular (Cagedcola-R), cujas múltiplas guanidínio pingentes de íon (Gu.+) são protegidos por um grupo de photocleavable aniônicos (butirato-substituídos nitroveratryloxycarbonyl; BA NVOC). Os hóspedes com cola de Caged-R são absorvidos vivos células através de endocitose e permanecem em endossomos. No entanto, após photoirradiation, Cagedcola-R é convertido em uncaged molecular cola (cola-RUncaged) carregando vários pingentes de Gu+ , que facilita a fuga de CDDP e translocação nuclear subsequente dos convidados. Este método é promissor para entrega da droga local-seletiva nuclear multiplataforma, desde que os convidados etiquetados podem migrar para o citoplasma, seguido pelo núcleo da célula apenas quando photoirradiated. Enjaulado Etiquetas de colagem-R podem entregar macromoleculares convidados como pontos quânticos (QDs) bem como convidados da pequeno-molécula. Enjaulado Etiquetas de colagem-R podem ser uncaged com luz UV, não só mas também dois fotões infravermelho próximo (NIR) a luz, que pode penetrar profundamente no tecido.
Introduction
O núcleo da célula, que carrega a informação genética, dentre as mais importantes organelas é como um destino de entrega da droga subcellular, desde modulação de replicação de gene e expressão é eficaz no tratamento de várias doenças, incluindo câncer e genética 1,2,3de distúrbios. Para nuclear entrega de drogas, a conjugação de peptídeo etiquetas tais como um sinal de localização nuclear a4,5,6 tem sido amplamente pesquisada. No entanto, a fim de reduzir os efeitos colaterais indesejados, controle spatiotemporal de translocação nuclear é necessário.
Anteriormente, acionada por luz translocação de proteínas para o núcleo celular foi conseguida usando enjaulado NLS7,8,9. NLS migra para o núcleo da célula por ligação a proteínas de transporte citoplasmáticos6. Nos métodos relatados, proteínas comentários enjaulado NLS do rolamento são diretamente incorporadas no citoplasma por microinjeção8 ou expressos nas células de destino usando um código genético expansão técnica9. Portanto, um método que pode alcançar tanto celular absorção e translocação nuclear induzida por foto é vantajoso para aplicações práticas.
Aqui, descrevemos a luz-acionou a translocação nuclear dos convidados em células vivas, usando tags dendríticas cola molecular enjaulado (Cagedcola-R, Figura 1). Water-soluble colas molecular10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 tendo vários pingentes de Gu+ têm sido desenvolvidos anteriormente, que aderem firmemente a proteínas11,12,13,14,15, 16,17, ácidos nucleicos18,19,20, de membranas fosfolipídicas21e argila nanosheets22,23 , através da formação de múltiplas pontes de sal entre seus pingentes Gu+ e oxyanionic grupos dos alvos. O pingentes de Gu+ de Cagedcola-R é protegido por um grupo de photocleavable aniônicos, nitroveratryloxycarbonyl butirato-substituídos (BANVOC). Os hóspedes com cola de Caged-R são absorvidos vivos células através de endocitose e estadia em endossomos (Figura 2). Sobre photoirradiation, os grupos NVOC BAde Cagedcola-R são desanexados para render uma uncaged molecular cola (cola deUncaged-R) carregando vários pingentes de Gu+ , que então facilita a migração do convidado etiquetado para o citoplasma, seguido-se o núcleo da célula (Figura 2). A marca de cola-R Cagedpode ser uncaged pela exposição a UV ou luz de dois fotões infravermelha (NIR) sem grave fototoxicidade. Demonstramos a entrega nuclear controlada spatiotemporally de macromoleculares convidados, bem como convidados da pequeno-molécula com etiquetas de colagem-R Caged, usando pontos quânticos (QDs) e uma tintura fluorescente (nitrobenzoxadiazole; NBD), respectivamente, como exemplos.
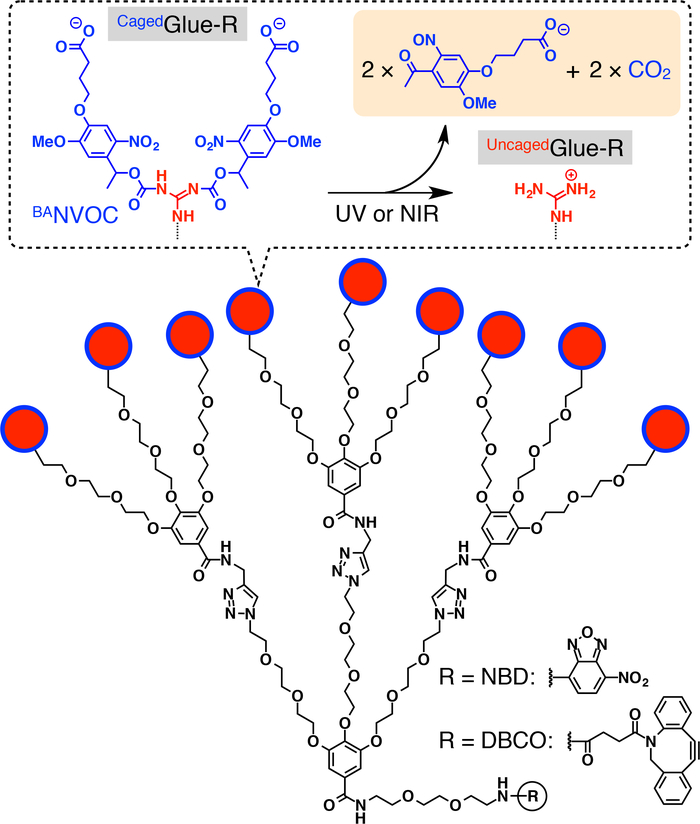
Figura 1: Estruturas esquemáticas do Cagedcola-R. Os 9 pendentes de íon (Gu.+) ultracentrifugation do Cagedcola-R são protegidos por um grupo de nitroveratryloxycarbonyl butirato-substituídos (BANVOC). Os grupos NVOC BAsão clivados por irradiação com UV ou luz NIR dois fotões. O núcleo focal do Cagedcola-R é acrescido com nitrobenzoxadiazole (NBD) ou dibenzocylooctyne (DBCO). Reproduzido com permissão da referência20. Clique aqui para ver uma versão maior desta figura.
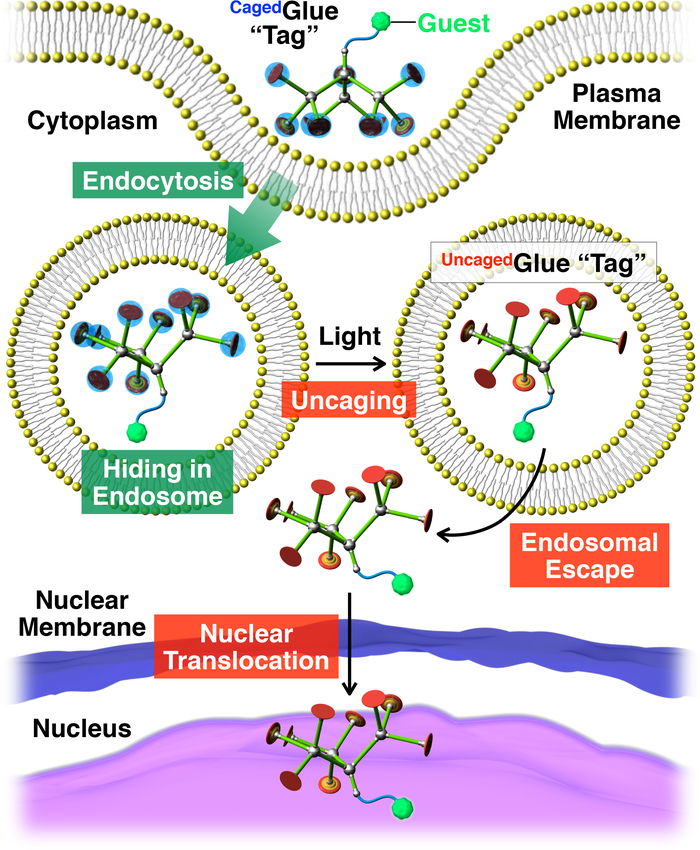
Figura 2: Ilustração esquemática da luz-acionou a translocação nuclear de convidados conjugados com uma marca de cola-R Caged. O convidado / conjugado de colagem-RCagedé retomado em vida células através de endocitose. Após a photoirradiation, a marca de cola-R Cagedé uncaged para produzir uma marca de cola-R Uncaged, que pode facilitar a fuga de CDDP do convidado marcado. Posteriormente, os comentários marcados migra para o núcleo da célula. Reproduzido com permissão da referência20. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Inquéritos anteriores de luz-acionou translocação de proteínas para o núcleo da célula foram obtidos usando enjaulado NLS7,8,9. Como mencionado anteriormente, esses métodos exigem técnicas adicionais para incorporar as proteínas NLS-marcados para o citoplasma. Em contraste, a nossa marca de cola-R Cagedpermite não só a translocação nuclear induzida por foto, mas também a captação celular dos convidados…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Reconhecemos o centro para a integração de NanoBio, da Universidade de Tóquio. Este trabalho foi apoiado por subsídio para jovens cientistas (B) (26810046) K.O. e parcialmente financiado por subsídio para pesquisa especialmente promovido (25000005) T.A. R.M. graças a bolsas de pesquisa de Japão sociedade para a promoção da ciência (JSPS ) para jovens cientistas e o programa para as principais escolas de pós-graduação (GPLLI).
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

